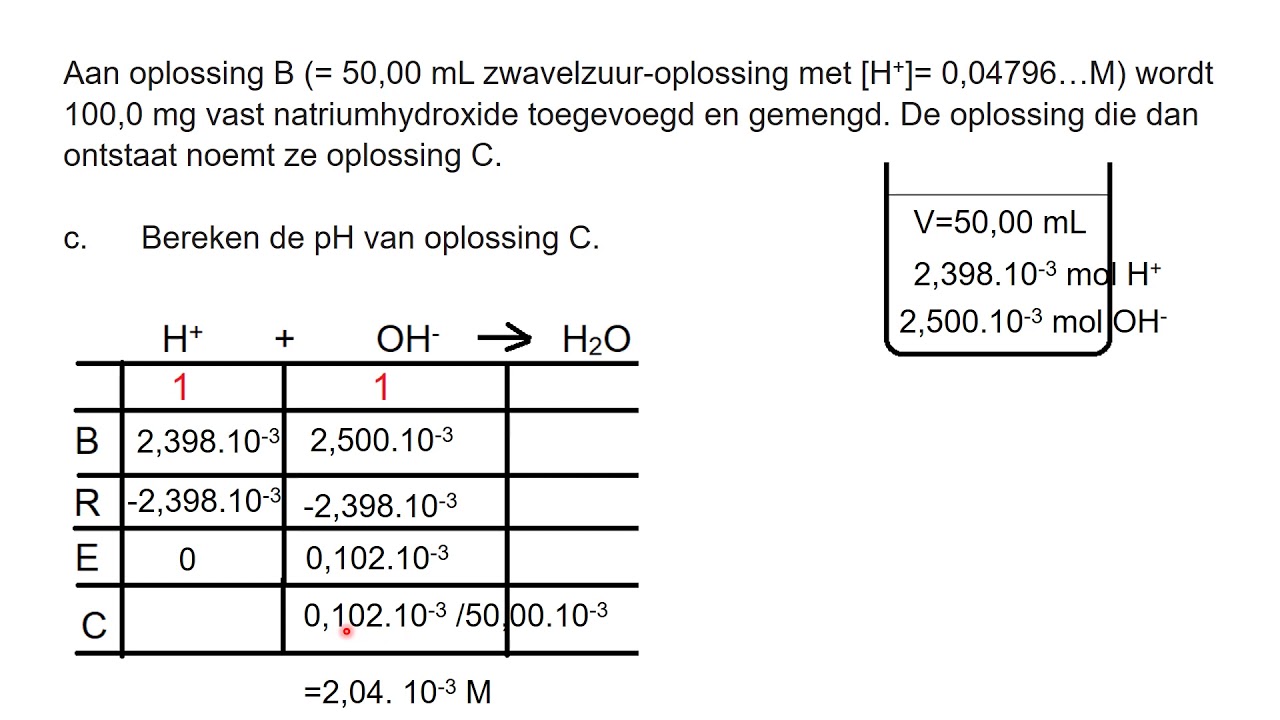
Hoe Bereken Je De Ph Van Een Oplossing

Heb je je ooit afgevraagd waarom sommige schoonmaakmiddelen zo agressief zijn, of waarom je vijverwater ineens niet meer helder is? Vaak heeft het allemaal te maken met de pH-waarde. Het klinkt misschien ingewikkeld, maar de pH-waarde berekenen is eigenlijk best te doen. In dit artikel gaan we je stap voor stap uitleggen hoe je dat kunt doen, zodat je voortaan zelf de zuurgraad van oplossingen kunt bepalen!
Wat is pH eigenlijk?
pH staat voor "potentieel waterstof" en is een maat voor de zuurgraad of basiciteit van een waterige oplossing. Het is een schaal van 0 tot 14, waarbij:
- pH < 7: Zuur
- pH = 7: Neutraal
- pH > 7: Basisch (ook wel alkalisch genoemd)
Een lage pH-waarde betekent dat er veel waterstofionen (H+) in de oplossing aanwezig zijn, wat de oplossing zuur maakt. Een hoge pH-waarde betekent dat er juist veel hydroxide-ionen (OH-) aanwezig zijn, wat de oplossing basisch maakt.
Waarom is dit belangrijk? De pH-waarde beïnvloedt tal van processen in ons dagelijks leven en in de wetenschap. Denk aan de chemische reacties in ons lichaam, de groei van planten in de tuin, de werking van schoonmaakmiddelen, en de stabiliteit van cosmetica. Volgens een rapport van de Wereldgezondheidsorganisatie (WHO) is de pH-waarde van drinkwater cruciaal voor de veiligheid en effectiviteit van desinfectiemiddelen.
Hoe bereken je de pH? De basisformule
De basisformule voor het berekenen van de pH is relatief eenvoudig:
pH = -log10[H+]
Hierbij staat [H+] voor de molaire concentratie van waterstofionen in de oplossing, uitgedrukt in mol per liter (mol/L).
Voorbeeld: Stel, je hebt een oplossing met een waterstofionenconcentratie van 0.001 mol/L (10-3 mol/L). Dan is de pH:
pH = -log10(0.001) = -log10(10-3) = -(-3) = 3
Deze oplossing is dus zuur.
pH berekenen: Stap-voor-stap uitleg
Laten we de stappen eens nader bekijken:
- Bepaal de waterstofionenconcentratie ([H+]): Dit is de belangrijkste stap. De concentratie kan gegeven zijn, of je moet deze bepalen aan de hand van andere gegevens, zoals de concentratie van een zuur of base.
- Neem de logaritme (grondtal 10) van de concentratie: Gebruik een rekenmachine om de log10 van de [H+] te vinden.
- Vermenigvuldig het resultaat met -1: Dit geeft je de pH-waarde.
Sterke zuren en basen
Bij sterke zuren en sterke basen is de berekening relatief eenvoudig, omdat ze volledig dissociëren in water. Dat betekent dat alle zuren of basen die je toevoegt, direct omgezet worden in waterstofionen (H+) of hydroxide-ionen (OH-).
Voorbeeld: Stel, je hebt een 0.01 mol/L oplossing van zoutzuur (HCl), een sterk zuur. Omdat HCl volledig dissocieert, is de [H+] ook 0.01 mol/L. Dus:
pH = -log10(0.01) = -log10(10-2) = -(-2) = 2
De pH van de zoutzuuroplossing is 2.
Voor sterke basen moeten we eerst de pOH berekenen en die vervolgens omzetten naar pH. De pOH wordt berekend met de volgende formule:
pOH = -log10[OH-]
Vervolgens kunnen we de pH berekenen met de volgende formule:
pH + pOH = 14 (bij 25°C)
Voorbeeld: Stel, je hebt een 0.005 mol/L oplossing van natriumhydroxide (NaOH), een sterke base. Omdat NaOH volledig dissocieert, is de [OH-] ook 0.005 mol/L. Dus:
pOH = -log10(0.005) ≈ 2.3
pH = 14 - pOH = 14 - 2.3 ≈ 11.7
De pH van de natriumhydroxide oplossing is ongeveer 11.7.
Zwakke zuren en basen
Bij zwakke zuren en zwakke basen is de berekening iets ingewikkelder, omdat ze niet volledig dissociëren in water. Dit betekent dat slechts een deel van de zuur- of base moleculen waterstofionen (H+) of hydroxide-ionen (OH-) vrijgeeft. We moeten rekening houden met de zuurconstante (Ka) of de baseconstante (Kb).
De Ka geeft aan hoe sterk een zuur is. Een hogere Ka betekent een sterker zuur (meer dissociatie). De Kb geeft aan hoe sterk een base is. Een hogere Kb betekent een sterkere base.
Voor zwakke zuren kunnen we de volgende benadering gebruiken (als de dissociatie klein is):
[H+] ≈ √(Ka * Czuur)
Hierbij is Czuur de beginconcentratie van het zwakke zuur.
Voorbeeld: Stel, je hebt een 0.1 mol/L oplossing van azijnzuur (CH3COOH), een zwak zuur met Ka = 1.8 x 10-5.
[H+] ≈ √(1.8 x 10-5 * 0.1) ≈ √(1.8 x 10-6) ≈ 0.00134 mol/L
pH = -log10(0.00134) ≈ 2.87
De pH van de azijnzuuroplossing is ongeveer 2.87.
Voor zwakke basen kunnen we een vergelijkbare benadering gebruiken, eerst de [OH-] berekenen en vervolgens de pOH en pH:
[OH-] ≈ √(Kb * Cbase)
Belangrijk: Deze benaderingen werken goed als de dissociatie van het zwakke zuur of de zwakke base klein is. Als de dissociatie groter is, moet je een meer nauwkeurige methode gebruiken, zoals de ICE-tabel (Initial, Change, Equilibrium).
Handige tips en aandachtspunten
- Temperatuur: De pH-waarde is temperatuurafhankelijk. De pH van neutraal water is bijvoorbeeld 7 bij 25°C, maar kan iets afwijken bij andere temperaturen.
- Ionsterkte: Hoge concentraties van opgeloste zouten kunnen de pH-waarde beïnvloeden.
- Gebruik van pH-meters: pH-meters zijn handige hulpmiddelen om de pH van een oplossing te meten. Zorg ervoor dat je de pH-meter regelmatig kalibreert met behulp van bufferoplossingen.
- Indicatoren: pH-indicatoren zijn stoffen die van kleur veranderen afhankelijk van de pH. Ze kunnen gebruikt worden om een schatting te maken van de pH-waarde. Bekende voorbeelden zijn lakmoespapier en universeel indicatorpapier.
- Bufferoplossingen: Bufferoplossingen zijn oplossingen die hun pH-waarde relatief constant houden, zelfs als er kleine hoeveelheden zuur of base aan worden toegevoegd. Ze zijn essentieel in veel chemische en biologische processen.
Waarom is pH-meting belangrijk in de praktijk?
Zoals gezegd heeft de pH-waarde invloed op veel aspecten van ons leven. Een paar voorbeelden:
- Landbouw: De pH van de bodem is cruciaal voor de groei van planten. Sommige planten gedijen in een zure bodem (bijvoorbeeld blauwe bessen), terwijl andere planten een basische bodem nodig hebben (bijvoorbeeld lavendel).
- Aquaria: De pH van het aquariumwater is belangrijk voor de gezondheid van vissen en andere waterorganismen.
- Voedselindustrie: De pH-waarde speelt een rol bij de houdbaarheid en smaak van voedingsmiddelen.
- Geneeskunde: De pH van bloed en andere lichaamsvloeistoffen moet binnen bepaalde grenzen blijven om de gezondheid te waarborgen.
- Schoonmaak: De pH van schoonmaakmiddelen beïnvloedt hun effectiviteit. Zure schoonmaakmiddelen zijn bijvoorbeeld geschikt voor het verwijderen van kalkaanslag, terwijl basische schoonmaakmiddelen geschikt zijn voor het verwijderen van vet.
Het begrijpen en kunnen berekenen van de pH-waarde is dus een waardevolle vaardigheid, die je in verschillende situaties van pas kan komen!
Conclusie
De pH-waarde is een cruciale parameter die de zuurgraad of basiciteit van een oplossing aangeeft. Door de basisformule pH = -log10[H+] te begrijpen en de stappen te volgen, kun je de pH van verschillende oplossingen berekenen. Houd rekening met de verschillen tussen sterke en zwakke zuren/basen en de invloed van factoren zoals temperatuur en ionsterkte. Met deze kennis kun je de pH-waarde beter begrijpen en toepassen in diverse praktische situaties.

Bekijk ook deze gerelateerde berichten:
- In Welke Luchtstreek Ligt Het Grootste Deel Van China
- Getal En Ruimte 1 Havo Vwo
- Wat Is De Wortel Van 169
- Hoe Kan Ik Mijn Bloedgroep Weten
- Hoe Voorkom Je Dat Je Ziek Word
- Wanneer Mag Je Geen Examen Doen
- Wat Is Een Abiotische Factor
- Hoe Lang Duurt Afrijden Met Auto
- De Bokser Het Leven Van Max Moszkowicz
- Kandidaat Van Putten Ger Gem In Ned Opheusden
