Hoe Bereken Je Protonen Neutronen En Elektronen
Het begrijpen van de structuur van atomen is fundamenteel in de scheikunde en natuurkunde. Een essentieel onderdeel hiervan is het kunnen bepalen van het aantal protonen, neutronen en elektronen in een atoom. Dit artikel zal uitleggen hoe je dit kunt doen, stap voor stap, zonder te simplistisch te worden.
Het Belang van Protonen, Neutronen en Elektronen
Protonen, neutronen en elektronen zijn de subatomaire deeltjes waaruit atomen zijn opgebouwd. Elk van deze deeltjes speelt een cruciale rol in de eigenschappen en het gedrag van een element.
Protonen: De Identiteit van het Element
Protonen bevinden zich in de kern van het atoom en hebben een positieve lading. Het aantal protonen bepaalt welk element het is. Dit aantal staat bekend als het atoomnummer (Z). Elk element in het periodiek systeem heeft een uniek atoomnummer. Bijvoorbeeld, elk atoom met één proton is waterstof (H), elk atoom met twee protonen is helium (He), enzovoort.
Neutronen: Stabiliteit en Isotopen
Neutronen bevinden zich ook in de kern en hebben geen lading (ze zijn neutraal). Ze dragen bij aan de massa van het atoom en helpen de kern stabiel te houden. Atomen van hetzelfde element kunnen een verschillend aantal neutronen hebben. Deze varianten noemen we isotopen. Het totale aantal protonen en neutronen in de kern wordt het massagetal (A) genoemd.
Elektronen: Chemische Reacties en Lading
Elektronen zijn negatief geladen en bevinden zich in banen rond de kern. Ze bepalen de chemische eigenschappen van een atoom, dat wil zeggen hoe het reageert met andere atomen. In een neutraal atoom is het aantal elektronen gelijk aan het aantal protonen, waardoor de totale lading van het atoom nul is. Als een atoom elektronen verliest of wint, wordt het een ion (een geladen atoom).
Hoe Bereken Je Protonen, Neutronen en Elektronen?
Nu we de basisprincipes kennen, kunnen we kijken naar de stappen om het aantal protonen, neutronen en elektronen in een atoom of ion te berekenen.
Stap 1: Identificeer het Atoomnummer (Z)
Het atoomnummer (Z) is het meest cruciale stukje informatie. Dit vind je in het periodiek systeem. Elk element heeft zijn eigen, unieke atoomnummer, dat vaak linksboven het elementsymbool staat aangegeven. Bijvoorbeeld, voor natrium (Na) is het atoomnummer 11.
Het atoomnummer is gelijk aan het aantal protonen. Dus, natrium (Na) heeft 11 protonen.
Stap 2: Bepaal het Massagetal (A)
Het massagetal (A) is het totale aantal protonen en neutronen in de kern. Het massagetal staat niet standaard in het periodiek systeem, omdat het afhankelijk is van de specifieke isotoop. Meestal wordt het massagetal gegeven als superscript links van het elementsymbool, bijvoorbeeld 23Na. Dit betekent dat deze specifieke isotoop van natrium een massagetal heeft van 23.
Stap 3: Bereken het Aantal Neutronen
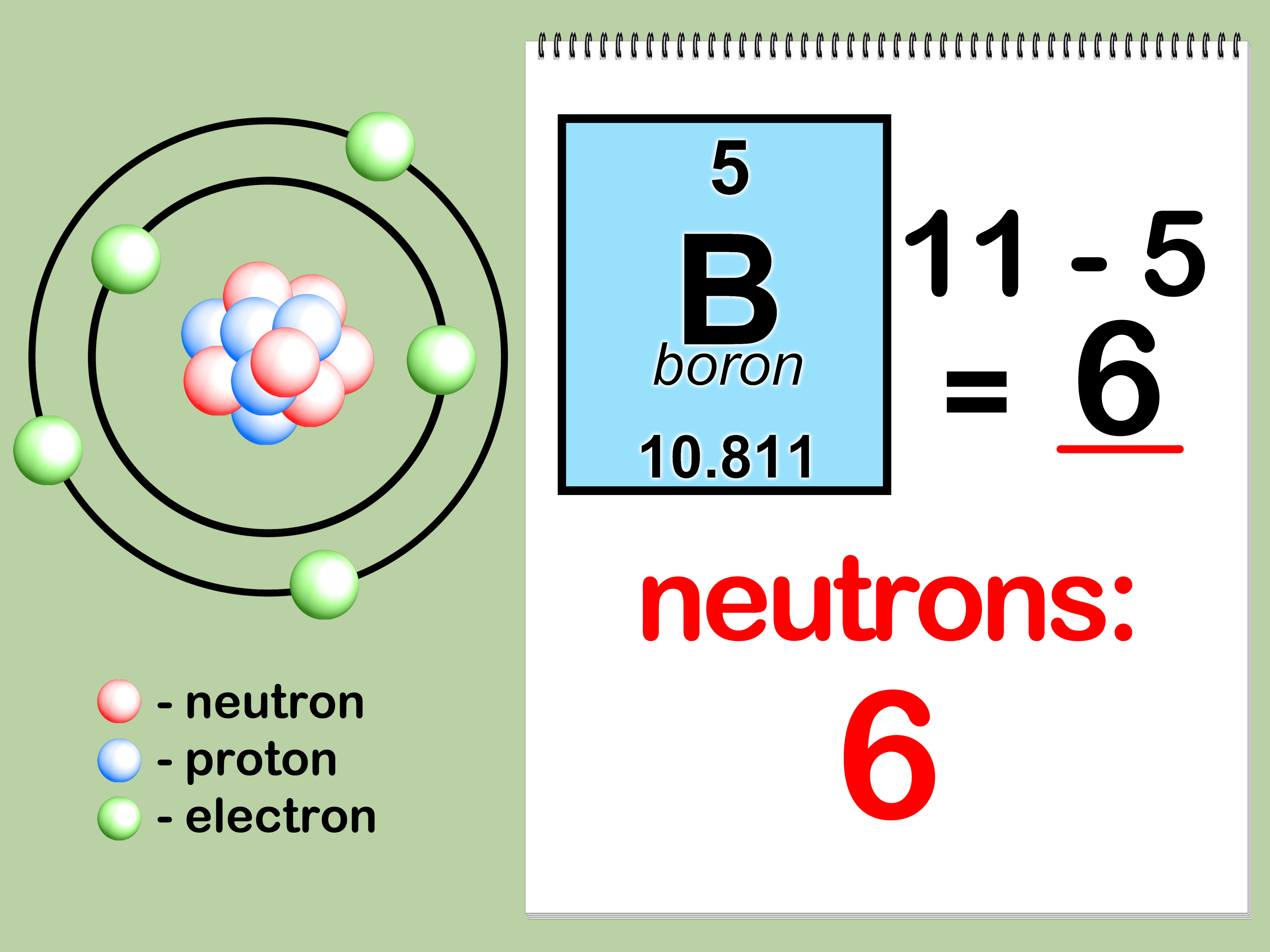
Om het aantal neutronen te berekenen, trek je het atoomnummer (Z) af van het massagetal (A):
Aantal neutronen = A - Z
Voor 23Na:
Aantal neutronen = 23 - 11 = 12
Dus, deze isotoop van natrium heeft 12 neutronen.
Stap 4: Bepaal het Aantal Elektronen
In een neutraal atoom is het aantal elektronen gelijk aan het aantal protonen. Dus, voor natrium (Na) met 11 protonen, heeft een neutraal natriumatoom ook 11 elektronen.
Als het atoom een ion is, dan heeft het een lading. Een positieve lading (kation) betekent dat het atoom elektronen heeft verloren, en een negatieve lading (anion) betekent dat het atoom elektronen heeft gewonnen.
- Positieve lading (kation): Trek de lading af van het aantal protonen. Bijvoorbeeld, Na+ heeft 11 protonen en een lading van +1. Aantal elektronen = 11 - 1 = 10.
- Negatieve lading (anion): Tel de lading op bij het aantal protonen. Bijvoorbeeld, Cl- heeft 17 protonen en een lading van -1. Aantal elektronen = 17 + 1 = 18.
Voorbeelden en Oefeningen
Laten we een paar voorbeelden bekijken om de concepten te verstevigen.
Voorbeeld 1: Koolstof-14 (14C)
Koolstof heeft een atoomnummer van 6 (Z = 6). De isotoop is koolstof-14, dus het massagetal is 14 (A = 14).
- Aantal protonen: 6
- Aantal neutronen: 14 - 6 = 8
- Aantal elektronen (neutraal atoom): 6
Voorbeeld 2: Zuurstofion (O2-)
Zuurstof heeft een atoomnummer van 8 (Z = 8). Laten we aannemen dat het massagetal 16 is (16O2-) - dit is de meest voorkomende isotoop.
- Aantal protonen: 8
- Aantal neutronen: 16 - 8 = 8
- Aantal elektronen (ion): 8 + 2 = 10 (vanwege de -2 lading heeft het ion twee extra elektronen)
Oefening: Bepaal de aantallen protonen, neutronen en elektronen voor de volgende soorten:
- 40K
- Mg2+
- 35Cl-
- 56Fe
Real-World Voorbeelden en Data
Het bepalen van het aantal protonen, neutronen en elektronen is niet alleen een theoretische oefening. Het heeft belangrijke praktische toepassingen in verschillende velden.
- Radioactieve datering: Koolstof-14 (14C) wordt gebruikt om de leeftijd van organische materialen te bepalen. De verhouding tussen 14C en 12C (de meest voorkomende koolstofisotoop) verandert in de loop van de tijd door radioactief verval. Door deze verhouding te meten, kunnen wetenschappers schatten hoe oud een object is.
- Medische beeldvorming: Isotopen zoals technetium-99m (99mTc) worden gebruikt in medische scans om organen en weefsels te visualiseren. De radioactieve verval van deze isotopen produceert gammastraling die kan worden gedetecteerd.
- Kernenergie: Uranium-235 (235U) wordt gebruikt in kernreactoren om energie op te wekken. De kernsplijting van 235U, waarbij de kern in kleinere kernen splitst, produceert een enorme hoeveelheid energie.
- Spectroscopie: De interactie van elektronen met licht wordt gebruikt in spectroscopie om de samenstelling van materialen te bepalen. Elk element absorbeert en emitteert licht bij specifieke golflengten, afhankelijk van de arrangement van de elektronen.
Deze voorbeelden illustreren hoe een diepgaand begrip van de atomaire structuur essentieel is voor vooruitgang in wetenschap en technologie.
Conclusie
Het berekenen van het aantal protonen, neutronen en elektronen in een atoom of ion is een fundamentele vaardigheid in de scheikunde en natuurkunde. Door het atoomnummer (Z), het massagetal (A) en de lading te begrijpen, kun je deze aantallen nauwkeurig bepalen. Deze kennis is cruciaal voor het begrijpen van de eigenschappen en het gedrag van elementen, en het heeft talloze toepassingen in de praktijk. Oefening baart kunst. Probeer verschillende voorbeelden en raadpleeg het periodiek systeem om je vaardigheden te verbeteren.
Neem de tijd om te oefenen en verdiep je verder in de materie. Een solide basis in de atomaire structuur zal je helpen om complexere chemische en fysische concepten beter te begrijpen.
Bekijk ook deze gerelateerde berichten:
- Is Dollar Meer Waard Dan Euro
- Hoeveel Dagen Tot 16 Juli
- Gewogen En Te Licht Bevonden
- Hoe Moet Je Een Brief Schrijven
- Hoeveel Telt Het Centraal Examen Mee
- Ds J Bos Cgk Leeftijd
- Ds A De Groot Leeftijd
- Avondgebed Voor Het Slapen Gaan
- Hoe Bereken Je Hoeveel Procent Iets Van Iets Is
- Bas Van Zuijlekom Dochter Overleden
