Hoe Weet Je Het Aantal Neutronen

Het begrijpen van de atomaire structuur is essentieel voor talloze wetenschappelijke disciplines, van scheikunde tot nucleaire fysica. Een cruciale component van een atoom is het neutron. Neutrons bevinden zich in de kern van een atoom, samen met protonen, en dragen significant bij aan de massa van het atoom. Weten hoeveel neutronen een atoom heeft is belangrijk voor het identificeren van elementen, het begrijpen van isotopen, en het voorspellen van chemische eigenschappen. Maar hoe bepalen we eigenlijk het aantal neutronen in een atoom?
De Basis: Atoomnummer en Massagetal
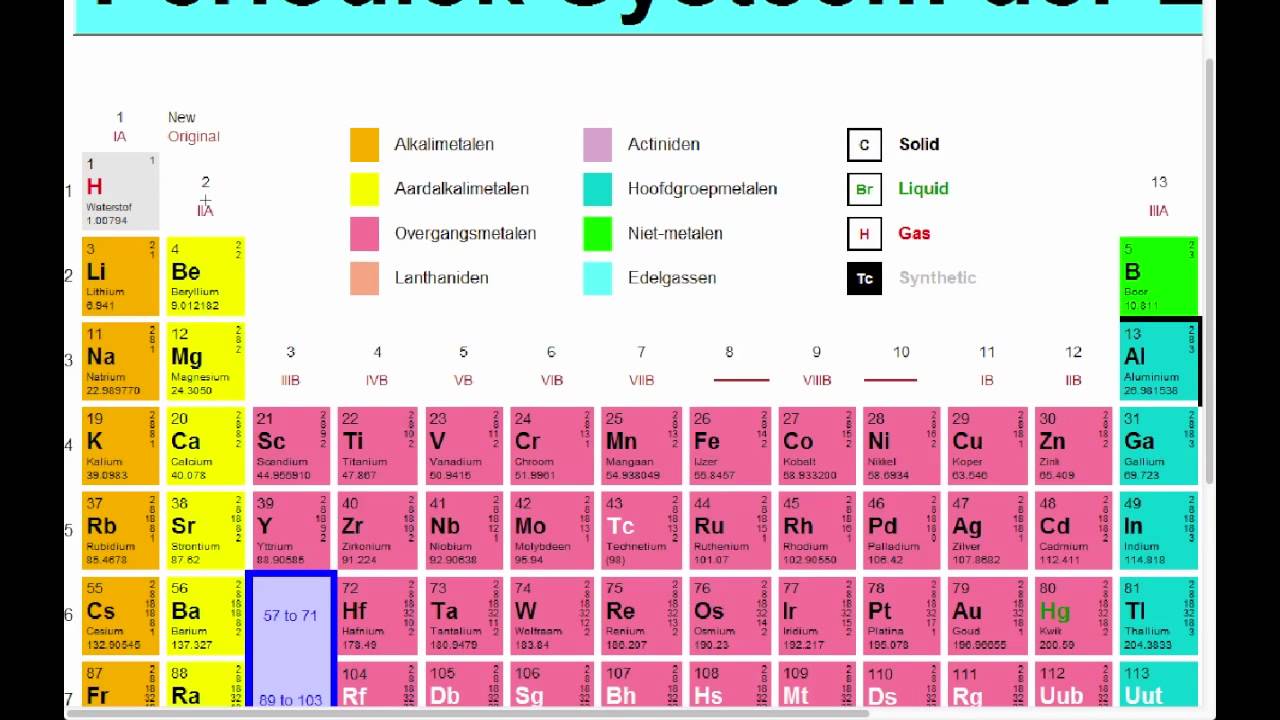
Om het aantal neutronen te bepalen, moeten we eerst twee fundamentele concepten begrijpen: het atoomnummer en het massagetal. Het atoomnummer is het aantal protonen in de kern van een atoom. Dit nummer is uniek voor elk element en definieert welk element het is. Zuurstof heeft bijvoorbeeld altijd 8 protonen (atoomnummer 8), en koolstof heeft altijd 6 protonen (atoomnummer 6). Je kunt het atoomnummer vinden in het periodiek systeem, boven het symbool van elk element.
Het massagetal daarentegen, is het totale aantal protonen én neutronen in de kern van een atoom. Het massagetal wordt niet vermeld op het periodiek systeem als een algemeen getal voor het element, omdat het kan variëren (zie het gedeelte over isotopen hieronder). Het is specifiek voor een bepaald atoom of een bepaalde isotoop. Dit getal staat vaak aangegeven naast het elementsymbool in de vorm van een superscript, bijvoorbeeld 12C of 14C.
De Formule: Massagetal - Atoomnummer = Aantal Neutronen
Met deze twee stukjes informatie, kunnen we de volgende eenvoudige formule gebruiken om het aantal neutronen te berekenen:
Aantal Neutronen = Massagetal - Atoomnummer
Stel dat we het aantal neutronen in een atoom koolstof-12 (12C) willen weten. Koolstof heeft een atoomnummer van 6 (het heeft dus 6 protonen). Het massagetal van koolstof-12 is 12. Dus:
Aantal Neutronen = 12 - 6 = 6
Koolstof-12 heeft dus 6 neutronen.
Isotopen: Variaties in Neutronen
De meeste elementen komen voor in verschillende vormen, genaamd isotopen. Isotopen van een element hebben hetzelfde aantal protonen (en dus hetzelfde atoomnummer), maar verschillen in het aantal neutronen. Dit betekent dat verschillende isotopen van hetzelfde element verschillende massagetallen hebben. Koolstof-12 (12C) en koolstof-14 (14C) zijn voorbeelden van isotopen van koolstof. Beide hebben 6 protonen, maar koolstof-12 heeft 6 neutronen, terwijl koolstof-14 er 8 heeft (14 - 6 = 8).
De meeste elementen hebben een mix van verschillende isotopen die in de natuur voorkomen. De relatieve atoommassa (ook wel atomair gewicht genoemd) die op het periodiek systeem staat, is een gewogen gemiddelde van de massagetallen van alle natuurlijke isotopen van dat element, rekening houdend met hun natuurlijke abundantie. Dit is waarom de relatieve atoommassa vaak geen geheel getal is.
Voorbeeld: Chloor
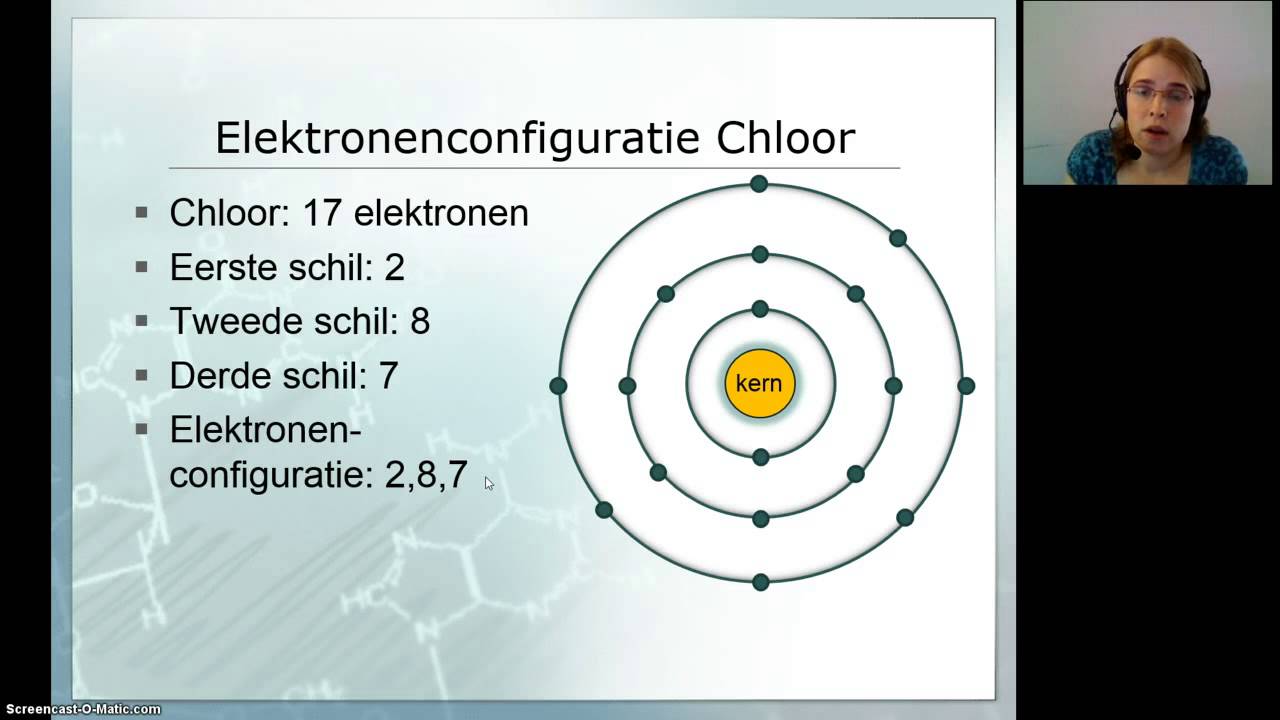
Chloor heeft twee belangrijke isotopen: chloor-35 (35Cl) en chloor-37 (37Cl). Chloor heeft een atoomnummer van 17 (dus 17 protonen).
- Chloor-35 heeft 35 - 17 = 18 neutronen.
- Chloor-37 heeft 37 - 17 = 20 neutronen.
De relatieve atoommassa van chloor die op het periodiek systeem staat, is ongeveer 35.45 u (atomaire massa-eenheden). Dit betekent dat chloor-35 vaker voorkomt in de natuur dan chloor-37.
Radioactief Verval en Neutronen
Het aantal neutronen in de kern van een atoom heeft een grote invloed op de stabiliteit van de kern. Sommige isotopen, vooral die met een onevenwichtige verhouding tussen protonen en neutronen, zijn radioactief. Dit betekent dat ze instabiel zijn en de neiging hebben om te vervallen, waarbij ze deeltjes en energie uitzenden. Neutronen kunnen een rol spelen in verschillende vormen van radioactief verval.
Bij neutronemissie zendt een instabiele kern direct een neutron uit om stabieler te worden. Dit is een zeldzaam type verval, maar het komt voor bij bepaalde zware elementen. Een meer gebruikelijke manier waarop het aantal neutronen de stabiliteit beïnvloedt, is indirect, via de verhouding met het aantal protonen. Een te veel aan neutronen kan leiden tot beta-min verval, waarbij een neutron wordt omgezet in een proton, een elektron en een antineutrino.
Voorbeeld: Koolstof-14
Koolstof-14 (14C) is een radioactieve isotoop van koolstof die wordt gebruikt bij radiometrische datering. Koolstof-14 is instabiel en vervalt via beta-min verval naar stikstof-14 (14N). Tijdens dit proces wordt een neutron in de kern omgezet in een proton, waardoor het atoom verandert van koolstof naar stikstof.
Praktische Toepassingen
Het bepalen van het aantal neutronen in atomen en isotopen heeft tal van praktische toepassingen in verschillende velden:
- Radiometrische Datering: Zoals hierboven vermeld, wordt de radioactieve verval van isotopen, zoals koolstof-14, gebruikt om de leeftijd van organisch materiaal te bepalen. De verhouding tussen koolstof-14 en koolstof-12 in een monster kan worden gebruikt om te schatten wanneer het organisme stierf.
- Nucleaire Geneeskunde: Radioactieve isotopen, zoals jodium-131 (131I), worden gebruikt voor diagnostische beeldvorming en behandeling van verschillende medische aandoeningen. Het begrip van het aantal neutronen en de stabiliteit van deze isotopen is cruciaal voor het veilig en effectief gebruik ervan.
- Kernenergie: Kernreactoren gebruiken de splijting van zware atomen, zoals uranium-235 (235U), om energie op te wekken. De splijtingsreactie produceert neutronen, die vervolgens andere uraniumatomen splijten, waardoor een kettingreactie ontstaat. Het beheer van het aantal neutronen in de reactor is essentieel voor het beheersen van de reactie en het voorkomen van een meltdown.
- Neutronenverstrooiing: Neutronenverstrooiingstechnieken worden gebruikt om de structuur en dynamica van materialen op atomaire schaal te onderzoeken. Neutronen zijn gevoelig voor lichte elementen zoals waterstof, wat ze complementair maakt aan röntgenstralen.
- Isotopenonderzoek: Stabiele isotopen worden gebruikt als tracers in verschillende wetenschappelijke studies, bijvoorbeeld in de ecologie om voedselketens te bestuderen of in de geochemie om de oorsprong van watermassa's te bepalen.
Voorbeeld: Kernsplijting van Uranium-235
Wanneer uranium-235 (235U) een neutron absorbeert, wordt het instabiel en splijt het in twee kleinere kernen, bijvoorbeeld barium-141 (141Ba) en krypton-92 (92Kr), plus een aantal neutronen (meestal 2 of 3). Deze vrijgekomen neutronen kunnen op hun beurt andere uranium-235 atomen splijten, waardoor een kettingreactie ontstaat. De energie die vrijkomt bij deze reactie wordt gebruikt in kerncentrales om elektriciteit op te wekken.
Conclusie: Het Belang van Neutronen begrijpen
Het bepalen van het aantal neutronen in een atoom is een fundamentele vaardigheid in de wetenschap. Door het atoomnummer en het massagetal te kennen, kunnen we eenvoudig het aantal neutronen berekenen en inzicht krijgen in de isotopen van een element, hun stabiliteit, en hun gedrag in chemische reacties en nucleaire processen. Van radiometrische datering tot kernenergie en medische toepassingen, het begrip van neutronen is essentieel voor vele belangrijke wetenschappelijke en technologische vooruitgangen.
Verdiep je verder in de wereld van de atomaire structuur! Onderzoek verschillende isotopen, leer over radioactief verval, en ontdek de vele manieren waarop onze kennis van neutronen de wereld om ons heen vormgeeft. Daag jezelf uit om het aantal neutronen te berekenen van verschillende elementen en isotopen, en deel je kennis met anderen.
Bekijk ook deze gerelateerde berichten:
- Ds R W Mulder Montfoort
- Waarom Kantelt Het Economisch Wereldbeeld
- Wat Is Het Effect Van Dopamine
- Hoe Noem Je Een Groep Organen Die Samenwerken
- Hoe Bereken Je Het Prijsindexcijfer
- Van Lc Terug Naar Lb
- 1 Oktober 2024 Welke Dag
- Ds B Van Leeuwen Emeritaat
- Hoe Laat Wordt Je Gebeld Voor Examenuitslag
- Voorbeeld Offerte In Het Engels
