Hoe Weet Je Of Een Stof Polair Of Apolair Is
Heb je je ooit afgevraagd waarom olie en water niet mengen? Of waarom sommige stoffen gemakkelijk oplossen in alcohol, terwijl andere dat absoluut niet doen? Het antwoord ligt in een fundamenteel concept in de chemie: polariteit. In dit artikel gaan we dieper in op polariteit, wat het betekent, en hoe je kunt bepalen of een stof polair of apolair is. Dit is nuttige kennis voor iedereen die geïnteresseerd is in wetenschap, van studenten scheikunde tot mensen die gewoon nieuwsgierig zijn naar de wereld om hen heen.
Wat is Polariteit?
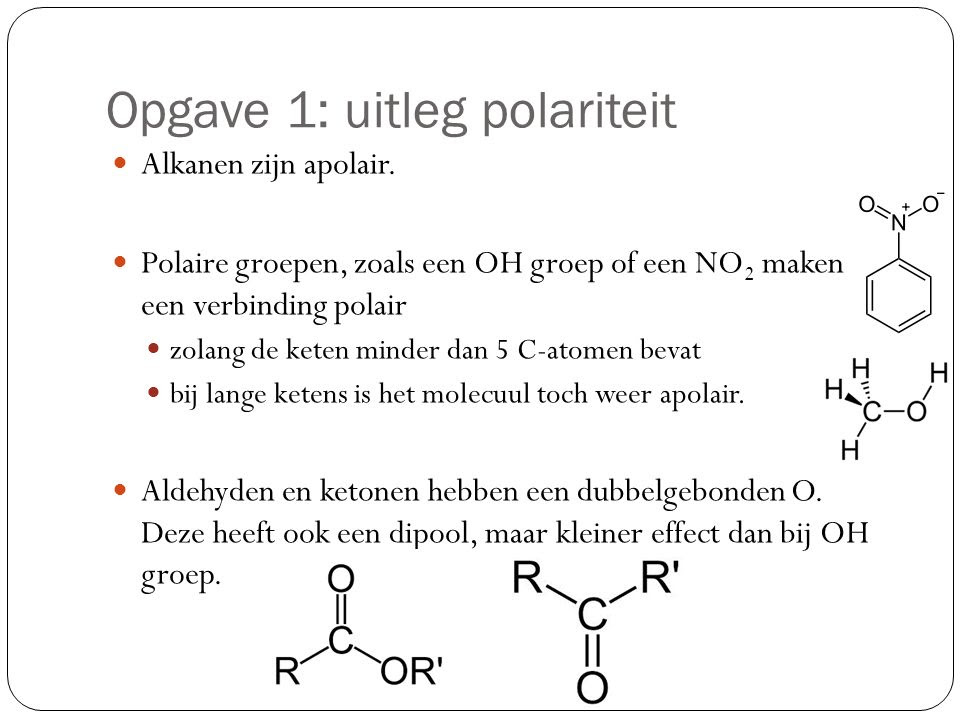
Polariteit in de chemie verwijst naar de ongelijke verdeling van elektronendichtheid binnen een molecule. Stel je voor dat elektronen, de negatief geladen deeltjes die rond de atoomkern cirkelen, niet gelijkmatig over een molecule zijn verdeeld. Dit creëert een gedeeltelijke negatieve lading (δ-) aan de ene kant van de molecule en een gedeeltelijke positieve lading (δ+) aan de andere kant. Dit is wat een molecuul polair maakt.
Een apolair molecuul daarentegen heeft een gelijke verdeling van elektronendichtheid. Er is geen significant verschil in lading aan de ene kant van de molecule ten opzichte van de andere. Je kan het zien alsof de elektronen heel eerlijk verdeeld worden tussen de atomen.
Hoe ontstaat polariteit?
Polariteit ontstaat voornamelijk door twee factoren:
- Elektronegativiteit: Dit is de maat voor de aantrekkingskracht van een atoom op elektronen in een chemische binding. Atomen met een hogere elektronegativiteit trekken elektronen sterker aan dan atomen met een lagere elektronegativiteit.
- Moleculaire geometrie: De ruimtelijke rangschikking van atomen in een molecule speelt een cruciale rol. Zelfs als een molecule polaire bindingen bevat, kan de algehele molecuul apolair zijn als de polariteiten elkaar opheffen.
De Rol van Elektronegativiteit
Elektronegativiteit is een sleutelconcept om te begrijpen hoe polariteit ontstaat. De Pauling-schaal is een veelgebruikte schaal om de elektronegativiteit van elementen weer te geven. Fluor (F) is het meest elektronegatieve element (ongeveer 4.0), terwijl cesium (Cs) het minst elektronegatieve element is (ongeveer 0.79).
Wanneer twee atomen met een significant verschil in elektronegativiteit een binding vormen, ontstaat een polaire covalente binding. Het meer elektronegatieve atoom trekt de elektronen dichter naar zich toe, waardoor het een gedeeltelijke negatieve lading krijgt (δ-) en het minder elektronegatieve atoom een gedeeltelijke positieve lading (δ+).
Hier zijn enkele voorbeelden:
- Water (H₂O): Zuurstof (O) is veel elektronegatiever dan waterstof (H). Daarom trekt zuurstof de elektronen in de O-H bindingen sterker aan, waardoor zuurstof een gedeeltelijke negatieve lading krijgt en de waterstofatomen een gedeeltelijke positieve lading.
- Ammoniak (NH₃): Stikstof (N) is elektronegatiever dan waterstof (H), waardoor een polaire binding ontstaat.
De Invloed van Moleculaire Geometrie
Zelfs als een molecule polaire bindingen bevat, wil dat nog niet zeggen dat de hele molecule polair is. De moleculaire geometrie is cruciaal. Als de polaire bindingen in een molecule zodanig gerangschikt zijn dat hun dipoolmomenten elkaar opheffen, is de molecule als geheel apolair.
Een dipoolmoment is een vector die de grootte en richting van de polariteit in een binding weergeeft. Het wijst van de positieve lading naar de negatieve lading. Als al deze vectoren (dipoolmomenten) in een molecuul elkaar precies neutraliseren is het een apolair molecuul.
Hier zijn enkele voorbeelden:
- Koolstofdioxide (CO₂): CO₂ heeft twee polaire C=O bindingen. De molecule is echter lineair, wat betekent dat de twee dipoolmomenten in tegengestelde richting wijzen en elkaar opheffen. Daarom is CO₂ een apolair molecuul.
- Methaan (CH₄): CH₄ heeft vier polaire C-H bindingen. De molecule is echter tetraëdrisch. Door de symmetrische rangschikking heffen de dipoolmomenten elkaar op, waardoor CH₄ een apolair molecuul is.
Een goed voorbeeld om het verschil te illustreren is water (H₂O) en koolstofdioxide (CO₂). Beide moleculen bevatten polaire bindingen. Water is echter gebogen, waardoor de dipoolmomenten elkaar niet opheffen, en dus is water een polair molecuul. CO₂ is lineair waardoor de dipoolmomenten elkaar wel opheffen en de molecule apolair is.
Hoe weet je of een stof polair of apolair is?
Het bepalen of een stof polair of apolair is, kan in stappen gebeuren:
- Bepaal de elektronegativiteit van de atomen: Gebruik een periodiek systeem met elektronegativiteitswaarden (zoals de Pauling-schaal) om de elektronegativiteit van elk atoom in de molecule te bepalen.
- Identificeer polaire bindingen: Als er een significant verschil is in elektronegativiteit tussen twee atomen in een binding (meestal een verschil groter dan 0.4), beschouw de binding dan als polair.
- Teken de Lewisstructuur: Teken de Lewisstructuur van de molecule om de rangschikking van de atomen en de vrije elektronenparen te visualiseren.
- Bepaal de moleculaire geometrie: Gebruik de VSEPR-theorie (Valence Shell Electron Pair Repulsion) om de moleculaire geometrie te voorspellen.
- Analyseer de dipoolmomenten: Teken de dipoolmomenten voor elke polaire binding. Als de dipoolmomenten elkaar opheffen, is de molecule apolair. Als de dipoolmomenten elkaar niet opheffen, is de molecule polair.
Vuistregels
Hoewel de bovenstaande stappen de meest nauwkeurige manier zijn om de polariteit te bepalen, zijn er enkele vuistregels die je kunt gebruiken:
- Moleculen die alleen uit dezelfde atomen bestaan zijn apolair: Bijvoorbeeld, H₂, O₂, N₂, Cl₂ zijn allemaal apolair. Dit komt omdat de elektronegativiteit van beide atomen gelijk is.
- Moleculen met een symmetrische geometrie en identieke atomen rond een centraal atoom zijn vaak apolair: Bijvoorbeeld, CCl₄ (tetrachloormethaan) is apolair.
- Moleculen met vrije elektronenparen op het centrale atoom zijn vaak polair: Bijvoorbeeld, water (H₂O) en ammoniak (NH₃) zijn polair. De vrije elektronenparen beïnvloeden de moleculaire geometrie en voorkomen dat de dipoolmomenten elkaar opheffen.
- Grote koolwaterstofketens (alleen C en H) zijn meestal apolair: Denk aan oliën en vetten. Hoewel er kleine verschillen in elektronegativiteit zijn, is het verschil te klein om significant polair te zijn.
Polariteit in de Praktijk
Polariteit heeft enorme gevolgen voor de eigenschappen en het gedrag van stoffen. Hier zijn enkele voorbeelden:
- Oplosbaarheid: De regel "gelijk lost gelijk op" is gebaseerd op polariteit. Polaire oplosmiddelen (zoals water) lossen polaire stoffen (zoals zout, suiker) goed op. Apolair oplosmiddelen (zoals benzeen, hexaan) lossen apolaire stoffen (zoals vetten, oliën) goed op. Dit verklaart waarom olie en water niet mengen. Water is polair en olie is apolair.
- Kookpunt: Polaire moleculen hebben vaak hogere kookpunten dan apolaire moleculen met een vergelijkbare molecuulmassa. Dit komt doordat de intermoleculaire krachten (zoals dipool-dipool interacties en waterstofbruggen) tussen polaire moleculen sterker zijn.
- Oppervlaktespanning: Polaire vloeistoffen hebben vaak een hogere oppervlaktespanning dan apolaire vloeistoffen. Dit is te wijten aan de sterkere cohesiekrachten tussen de polaire moleculen.
- Biologische systemen: Polariteit is cruciaal in biologische systemen. Water is het belangrijkste oplosmiddel in levende organismen, en de polariteit van water is essentieel voor veel biologische processen, zoals de structuur en functie van eiwitten en DNA.
Samenvatting
Het bepalen of een stof polair of apolair is, is gebaseerd op de verdeling van elektronendichtheid binnen een molecule. Dit wordt beïnvloed door de elektronegativiteit van de atomen en de moleculaire geometrie. Polaire moleculen hebben een ongelijke verdeling van lading, terwijl apolaire moleculen een gelijke verdeling hebben. Het begrijpen van polariteit is essentieel om de eigenschappen en het gedrag van stoffen te voorspellen, van oplosbaarheid tot kookpunt en biologische processen.
Dus, de volgende keer dat je ziet dat olie en water niet mengen, of wanneer je nadenkt over hoe een zeep je handen schoonmaakt, weet je dat de sleutel tot dit gedrag ligt in het fascinerende concept van polariteit.
Bekijk ook deze gerelateerde berichten:
- Hoe Planten Planten Zich Voort
- Klein Bruin Vogeltje Lijkt Op Mus
- In Welke Wet Zijn Zowel Strafbare Feiten Als Bevoegdheden Opgenomen
- Is Wiskunde Verplicht Op Havo
- Enkeling Te Vaak Centraal Gesteld
- What Is A Past Simple
- N Term Nederlands Havo 2024
- Wat Is De Hoofdstad Van Brazilie
- Ds Bakelaar Krimpen Aan De Lek
- Wat Is Geloven Volgens De Bijbel
