Wat Is Een Katalysator Scheikunde
Stel je voor: je wilt een heerlijke taart bakken. Je hebt alle ingrediënten, maar de reactie – het bakproces – verloopt veel te langzaam. Wat doe je? Je voegt een beetje bakpoeder toe! In de scheikunde is een katalysator te vergelijken met dat bakpoeder. Het versnelt chemische reacties zonder zelf verbruikt te worden. Dit artikel is bedoeld voor iedereen die nieuwsgierig is naar scheikunde, van middelbare scholieren tot hobby-wetenschappers, en willen begrijpen wat een katalysator precies is en hoe het werkt.
Wat is een Katalysator? Een Definitie
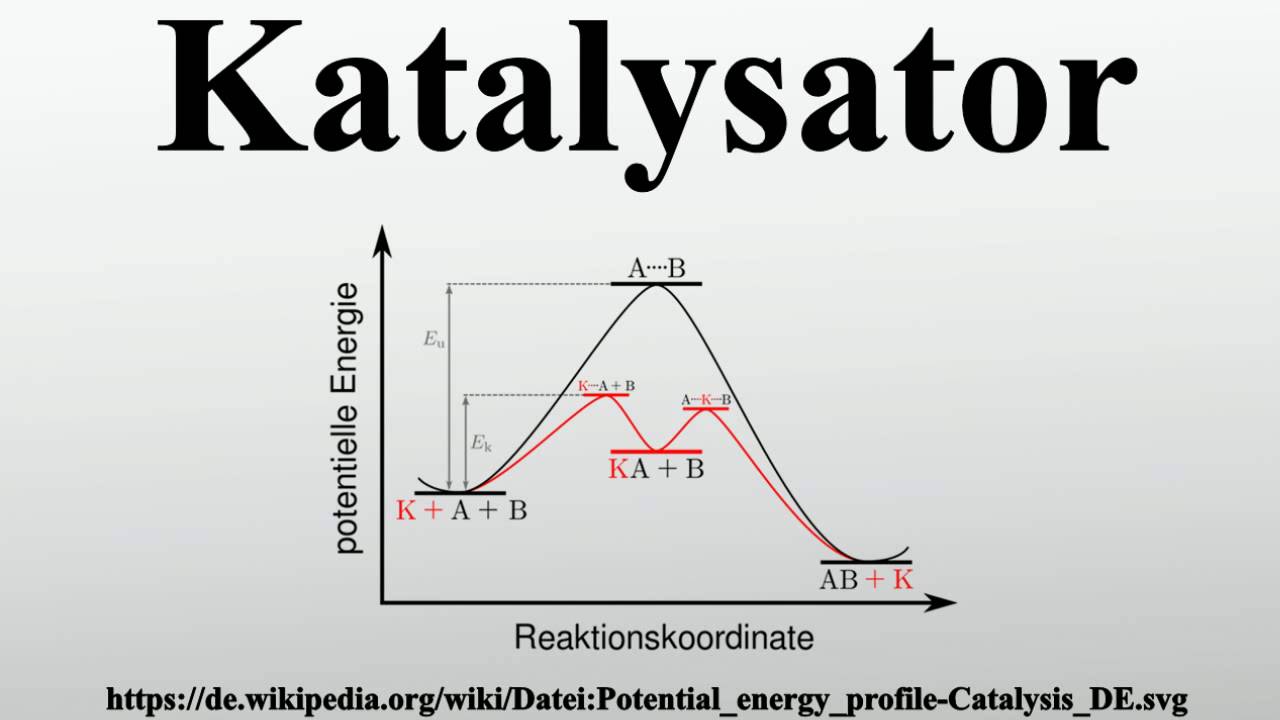
Een katalysator is een stof die een chemische reactie versnelt zonder zelf permanent te veranderen of verbruikt te worden in de reactie. Na de reactie is de katalysator in principe nog steeds aanwezig en kan deze weer gebruikt worden om dezelfde reactie te versnellen. Het is belangrijk om te benadrukken dat een katalysator de evenwichtsconstante van een reactie niet verandert; het versnelt simpelweg de snelheid waarmee het evenwicht wordt bereikt.
Hoe Werkt een Katalysator?
Katalysatoren werken door een alternatief reactiepad aan te bieden met een lagere activeringsenergie. Activeringsenergie is de energie die nodig is om een reactie te starten. Door de activeringsenergie te verlagen, kunnen meer moleculen de reactiebarrière overwinnen bij een bepaalde temperatuur, waardoor de reactie sneller verloopt. Stel je voor dat je een berg moet beklimmen om aan de andere kant te komen. Een katalysator legt een tunnel door die berg aan, waardoor de klim veel minder energie kost.
Er zijn verschillende mechanismen waarop een katalysator kan werken:
- Adsorptie: De reactanten (de stoffen die reageren) binden zich aan het oppervlak van de katalysator. Dit brengt ze dichter bij elkaar en kan hun bindingen verzwakken, waardoor de reactie gemakkelijker verloopt.
- Tussenproductvorming: De katalysator reageert met een van de reactanten om een instabiel tussenproduct te vormen. Dit tussenproduct reageert vervolgens verder om de producten te vormen, waarbij de katalysator weer vrijkomt.
- Zuur-base katalyse: De katalysator fungeert als een zuur of een base, waardoor de reactie sneller verloopt door protonen (H+) te doneren of te accepteren.
Soorten Katalysatoren
Katalysatoren kunnen worden ingedeeld in verschillende categorieën, afhankelijk van hun fase (vast, vloeibaar, gas) en hun werking.
Homogene Katalysatoren
Een homogene katalysator bevindt zich in dezelfde fase als de reactanten. Een voorbeeld hiervan is een zuur (zoals zwavelzuur) dat gebruikt wordt om de hydrolyse van een ester te versnellen. Zowel het zuur als de ester bevinden zich in een vloeibare oplossing.
Voordelen van homogene katalyse:
- Hoge activiteit en selectiviteit.
- Gemakkelijk te bestuderen en te begrijpen.
Nadelen van homogene katalyse:
- Moeilijk te scheiden van de producten.
- Corrosief en moeilijk te hergebruiken.
Heterogene Katalysatoren
Een heterogene katalysator bevindt zich in een andere fase dan de reactanten. Een veelvoorkomend voorbeeld is een vast metaal (zoals platina, palladium of nikkel) dat wordt gebruikt om de hydrogenering van alkenen te versnellen. De alkenen bevinden zich in een gas- of vloeibare fase, terwijl het metaal vast is.
Voordelen van heterogene katalyse:
- Gemakkelijk te scheiden van de producten.
- Herbruikbaar.
- Over het algemeen stabieler.
Nadelen van heterogene katalyse:
- Lagere activiteit en selectiviteit in vergelijking met homogene katalysatoren.
- Moeilijker te bestuderen en te begrijpen.
Enzymen: Biologische Katalysatoren
Enzymen zijn biologische katalysatoren, meestal eiwitten, die reacties in levende organismen versnellen. Ze zijn ongelooflijk specifiek en kunnen reacties miljoenen keren sneller laten verlopen dan zonder katalysator. Een voorbeeld is amylase, een enzym in speeksel dat zetmeel afbreekt tot suikers.
Voordelen van enzymatische katalyse:
- Hoge specificiteit.
- Werken onder milde omstandigheden (temperatuur, pH).
- Milieuvriendelijk.
Nadelen van enzymatische katalyse:
- Gevoelig voor denaturatie (verlies van structuur en functionaliteit) door temperatuur en pH.
- Kostbaar om te produceren en te isoleren.
Toepassingen van Katalysatoren
Katalysatoren spelen een cruciale rol in talloze industriële processen en toepassingen. Hier zijn enkele voorbeelden:
- Petrochemie: Katalytische cracking en reforming worden gebruikt om ruwe olie om te zetten in benzine, diesel en andere brandstoffen.
- Kunstmestproductie: Het Haber-Boschproces, dat ammoniak produceert uit stikstof en waterstof, gebruikt een ijzerkatalysator.
- Polymeerproductie: Katalysatoren worden gebruikt om polymeren zoals polyetheen en polypropeen te maken, die in plastics, verpakkingen en textiel worden gebruikt.
- Farmaceutische industrie: Katalysatoren worden gebruikt bij de synthese van medicijnen, waardoor de productie efficiënter en goedkoper wordt.
- Milieutechnologie: Katalysatoren worden gebruikt in katalysatoren in auto's om schadelijke uitlaatgassen (zoals koolmonoxide, stikstofoxiden en koolwaterstoffen) om te zetten in minder schadelijke stoffen (zoals koolstofdioxide, stikstof en water).
- Voedingsindustrie: Enzymen worden gebruikt bij de productie van kaas, bier, wijn en andere voedingsmiddelen.
Katalysatoren in het Dagelijks Leven
Hoewel je er misschien niet direct bij stilstaat, kom je in je dagelijks leven constant in aanraking met de effecten van katalysatoren:
- Auto's: Zoals eerder genoemd, zetten katalysatoren in uitlaatsystemen schadelijke gassen om in minder schadelijke stoffen, wat bijdraagt aan een schonere lucht.
- Wasmiddelen: Enzymen in wasmiddelen helpen bij het afbreken van vlekken, waardoor je kleding schoner wordt.
- Voedselvertering: Je lichaam gebruikt enzymen om voedsel af te breken en voedingsstoffen op te nemen.
- Batterijen: Katalysatoren in batterijen helpen bij het versnellen van de chemische reacties die elektriciteit produceren.
De Toekomst van Katalyse
Onderzoek naar katalysatoren is een actief en belangrijk gebied van de wetenschap. Wetenschappers zijn voortdurend op zoek naar nieuwe en betere katalysatoren die:
- Efficiënter zijn: Meer product produceren met minder katalysator.
- Selectiever zijn: Alleen de gewenste producten vormen, waardoor afval wordt verminderd.
- Duurzamer zijn: Gebaseerd zijn op hernieuwbare grondstoffen en minder schadelijk zijn voor het milieu.
- Robuuster zijn: Beter bestand zijn tegen extreme omstandigheden zoals hoge temperaturen en drukken.
De ontwikkeling van nieuwe katalysatoren is essentieel voor het oplossen van belangrijke uitdagingen op het gebied van energie, milieu en gezondheid. Denk aan de ontwikkeling van katalysatoren voor de productie van duurzame brandstoffen, de afvang en omzetting van CO2, en de synthese van nieuwe medicijnen.
Conclusie
Een katalysator is een onmisbare speler in de scheikunde en onze moderne samenleving. Door de activeringsenergie van een reactie te verlagen, versnellen ze chemische processen zonder zelf verbruikt te worden. Of het nu gaat om het produceren van brandstoffen, kunstmest, plastics, medicijnen of het reinigen van uitlaatgassen, katalysatoren spelen een cruciale rol. Door meer te leren over katalysatoren en hun toepassingen, kunnen we een beter begrip krijgen van de wereld om ons heen en bijdragen aan een duurzamere toekomst. Dus, de volgende keer dat je een taart bakt, denk dan even aan de katalysator, en hoe een klein beetje toevoeging een groot verschil kan maken!