Bij Hoeveel Graden Kookt Water
Het kookpunt van water is een fundamenteel concept in de natuurkunde en scheikunde, en het is cruciaal voor talloze toepassingen in ons dagelijks leven, van koken tot industriële processen. Hoewel de algemene kennis is dat water kookt bij 100 graden Celsius, is de realiteit iets complexer. Verschillende factoren kunnen het kookpunt beïnvloeden, waardoor het belangrijk is om een dieper begrip van dit fenomeen te hebben.
Wat is het Kookpunt en Waarom is het Belangrijk?
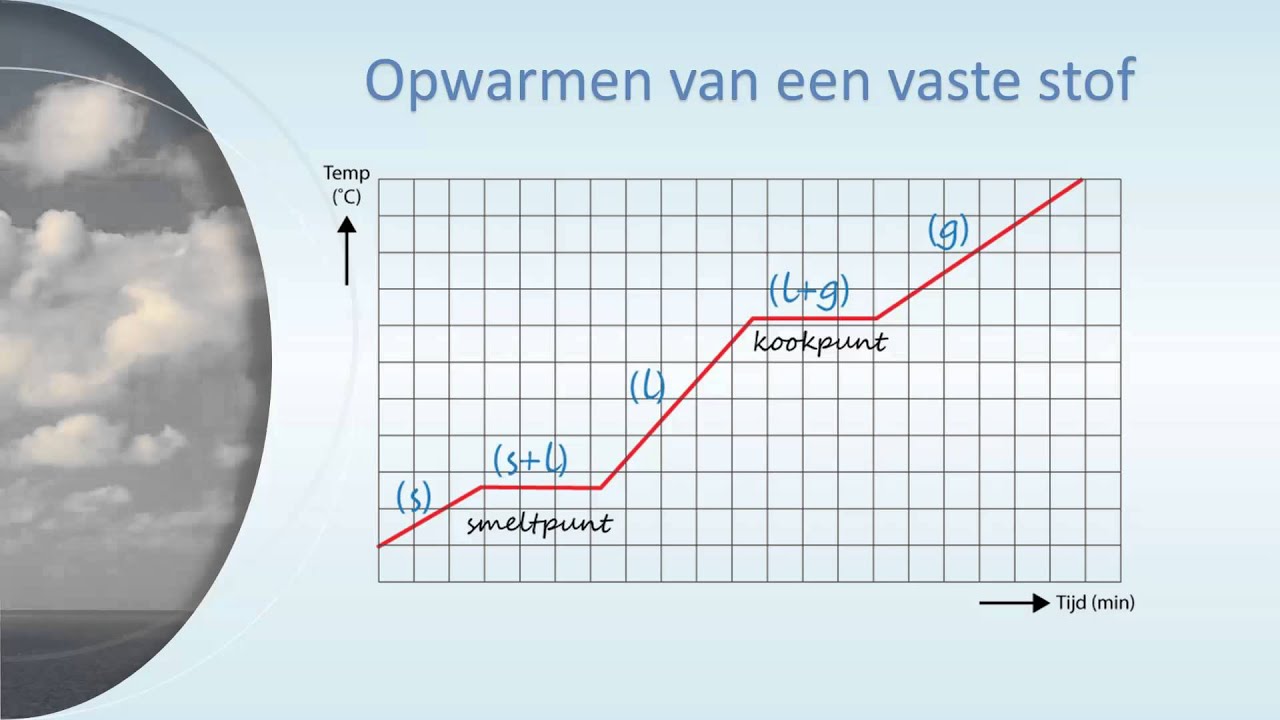
Het kookpunt is de temperatuur waarbij een vloeistof overgaat in een gasvormige toestand. Dit gebeurt wanneer de dampdruk van de vloeistof gelijk is aan de omgevingsdruk. Voor water betekent dit dat de watermoleculen voldoende energie hebben om de aantrekkingskrachten tussen hen te overwinnen en als waterdamp te ontsnappen.
Het kookpunt is van groot belang omdat het direct van invloed is op processen zoals:
- Koken en voedselbereiding: De temperatuur van kokend water is essentieel voor het bereiden van voedsel.
- Sterilisatie: Hoge temperaturen, bereikt door kokend water, worden gebruikt om bacteriën en andere micro-organismen te doden.
- Industriële processen: Veel industriële processen, zoals destillatie en stoomkrachtcentrales, zijn afhankelijk van de nauwkeurige controle van het kookpunt van water.
- Weersvoorspellingen: De verdamping van water speelt een cruciale rol in de vorming van wolken en neerslag.
De Basis: 100 Graden Celsius?
De algemeen aanvaarde temperatuur van 100 graden Celsius (of 212 graden Fahrenheit) voor het kookpunt van water is alleen correct onder standaard atmosferische druk. Standaard atmosferische druk wordt gedefinieerd als de gemiddelde atmosferische druk op zeeniveau, die ongeveer 101,325 kPa (kilopascal) of 1 atmosfeer (atm) bedraagt.
Dus, wanneer je zegt dat water kookt bij 100 graden Celsius, ga je impliciet uit van dat je je op zeeniveau bevindt en dat de atmosferische druk normaal is.
Factoren die het Kookpunt Beïnvloeden
Verschillende factoren kunnen het kookpunt van water beïnvloeden, waardoor het hoger of lager kan zijn dan 100 graden Celsius. De belangrijkste factoren zijn:
Atmosferische Druk
De belangrijkste factor die het kookpunt van water beïnvloedt, is de atmosferische druk. Hoe lager de atmosferische druk, hoe lager het kookpunt, en omgekeerd. Dit komt doordat de watermoleculen minder druk hoeven te overwinnen om te verdampen bij een lagere atmosferische druk.
Voorbeeld: Op de top van de Mount Everest, waar de atmosferische druk aanzienlijk lager is dan op zeeniveau, kookt water bij ongeveer 70 graden Celsius. Dit is de reden waarom het moeilijker is om voedsel goed te koken op grote hoogte, omdat de lagere kooktemperatuur minder energie levert voor het kookproces.
Omgekeerd, in een snelkookpan, waar de druk wordt verhoogd, kookt water bij een hogere temperatuur dan 100 graden Celsius. Dit versnelt het kookproces omdat de hogere temperatuur meer energie levert.
Opgeloste Stoffen
De aanwezigheid van opgeloste stoffen in water, zoals zout of suiker, verhoogt het kookpunt. Dit fenomeen staat bekend als kookpuntsverhoging. De opgeloste stoffen verlagen de dampdruk van het water, waardoor een hogere temperatuur nodig is om het kookpunt te bereiken.
Voorbeeld: Het toevoegen van zout aan water bij het koken van pasta verhoogt het kookpunt enigszins. Hoewel het effect niet dramatisch is (een kleine hoeveelheid zout heeft een klein effect), kan het bij grotere hoeveelheden zout een merkbaar verschil maken.
Zuiverheid van het Water
Hoewel opgeloste stoffen het kookpunt verhogen, kan de aanwezigheid van bepaalde verontreinigingen, zoals organische stoffen, het kookgedrag van water beïnvloeden. Deze verontreinigingen kunnen het kookproces destabiliseren en leiden tot onvoorspelbare kooktemperaturen.
Oppervlaktespanning
Oppervlaktespanning kan het kookpunt enigszins beïnvloeden, vooral in kleine volumes of bij de aanwezigheid van bepaalde oppervlakken. De oppervlaktespanning kan de vorming van dampbellen belemmeren, waardoor een hogere temperatuur nodig is om het kookproces te starten.
Data en Voorbeelden
Laten we enkele concrete voorbeelden en data bekijken om de impact van atmosferische druk op het kookpunt van water te illustreren:
- Ze niveau (1 atm): Kookpunt = 100 graden Celsius
- 1500 meter hoogte (ongeveer 0.84 atm): Kookpunt = ongeveer 95 graden Celsius
- 3000 meter hoogte (ongeveer 0.7 atm): Kookpunt = ongeveer 90 graden Celsius
- Mount Everest (ongeveer 0.33 atm): Kookpunt = ongeveer 70 graden Celsius
Deze data laten duidelijk zien hoe het kookpunt daalt naarmate de hoogte toeneemt en de atmosferische druk afneemt.
Voorbeeld uit de voedingsindustrie: Voedselproducenten moeten rekening houden met de hoogte waarop hun producten worden gekookt. Op grote hoogte vereist het koken van voedsel langere kooktijden of aanpassingen aan de recepten om ervoor te zorgen dat het voedsel volledig gaar is.
Voorbeeld in de chemische industrie: In chemische laboratoria wordt het kookpunt vaak gebruikt om de zuiverheid van een stof te bepalen. Een zuivere stof heeft een scherp en constant kookpunt, terwijl een onzuivere stof een kooktraject heeft over een reeks temperaturen.
Kookpunt versus Damping
Het is belangrijk om onderscheid te maken tussen koken en verdamping. Verdamping is het proces waarbij een vloeistof langzaam overgaat in een gasvormige toestand, zelfs bij temperaturen onder het kookpunt. Koken daarentegen is een sneller en heftiger proces dat optreedt wanneer de dampdruk van de vloeistof gelijk is aan de omgevingsdruk.
Verdamping gebeurt continu, zelfs bij kamertemperatuur. Denk aan een plas water die langzaam verdwijnt op een warme dag. Koken vereist daarentegen een aanzienlijke toevoer van warmte om de benodigde temperatuur te bereiken.
Conclusie
Het kookpunt van water is niet zomaar een vaststaand getal; het is een complex fenomeen dat wordt beïnvloed door verschillende factoren, met name de atmosferische druk en de aanwezigheid van opgeloste stoffen. Hoewel 100 graden Celsius een goede vuistregel is op zeeniveau, is het cruciaal om te begrijpen dat het kookpunt kan variëren afhankelijk van de omgeving.
Een goed begrip van het kookpunt van water is essentieel voor een breed scala aan toepassingen, van koken en voedselbereiding tot industriële processen en wetenschappelijk onderzoek. Door rekening te houden met de factoren die het kookpunt beïnvloeden, kunnen we processen optimaliseren, nauwkeurige resultaten bereiken en veilige en efficiënte procedures garanderen.
Oproep tot actie: Experimenteer zelf! Meet het kookpunt van water op verschillende hoogtes (indien mogelijk) of voeg verschillende hoeveelheden zout of suiker toe aan water en observeer de veranderingen in het kookgedrag. Dit helpt om het concept van het kookpunt en de factoren die het beïnvloeden beter te begrijpen.

Bekijk ook deze gerelateerde berichten:
- Het Weer 31 December 2023
- Ik Hou Van Holland Spel Onderdelen
- Temperaturen In Mei In Europa
- Waar Is De Koning Op Koningsdag
- Welke Landen Doen Er Mee Aan Het Ek 2024
- Tellen Hoe Ver Onweer Weg Is
- Essential Mathematics For Economic Analysis 6th Edition
- Verpleegkundige Humor In De Zorg
- Where The Crawdads Sing Vertaling
- De Kunst Van Het Veranderen
