Is Water Een Zuivere Stof
De vraag of water, ofwel H₂O, een zuivere stof is, lijkt op het eerste gezicht misschien eenvoudig. Echter, de realiteit is complexer dan je zou denken. In de scheikunde is het onderscheid tussen een zuivere stof en een mengsel fundamenteel. Dit artikel duikt diep in de eigenschappen van water en onderzoekt of het aan de criteria voor een zuivere stof voldoet. We zullen verschillende perspectieven bekijken, inclusief theoretische definities en praktische observaties.
Wat is een Zuivere Stof?
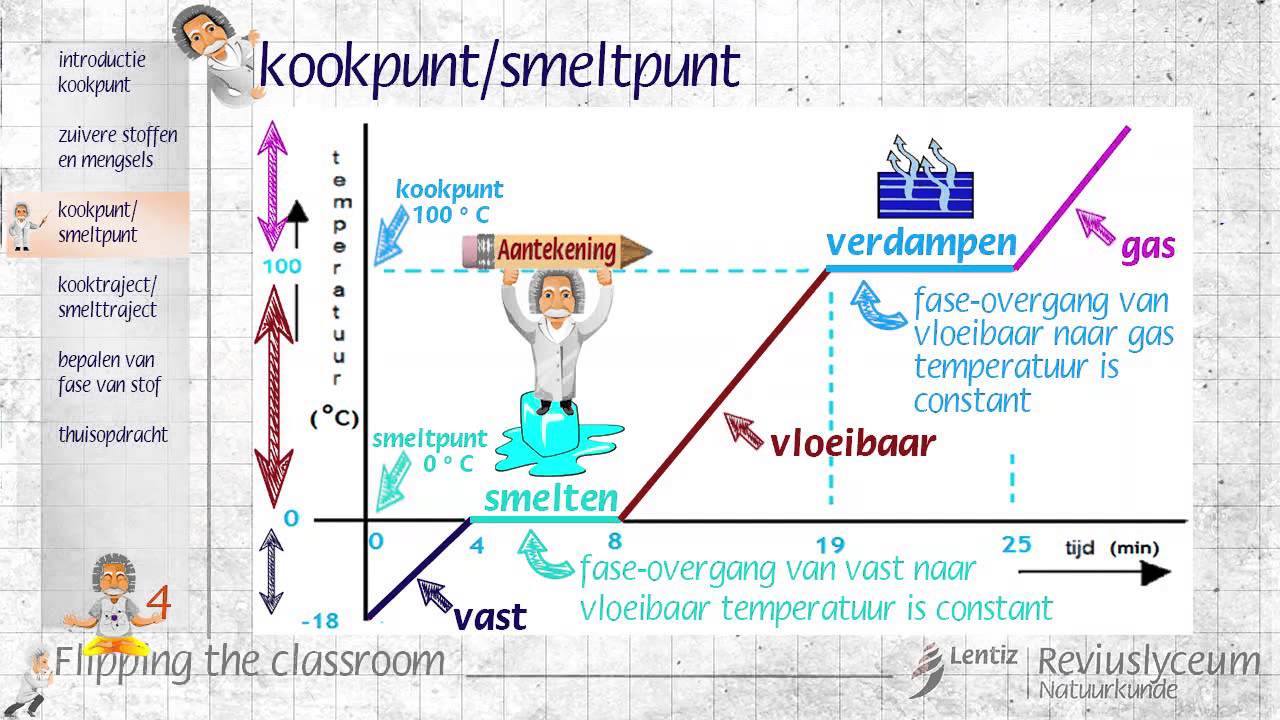
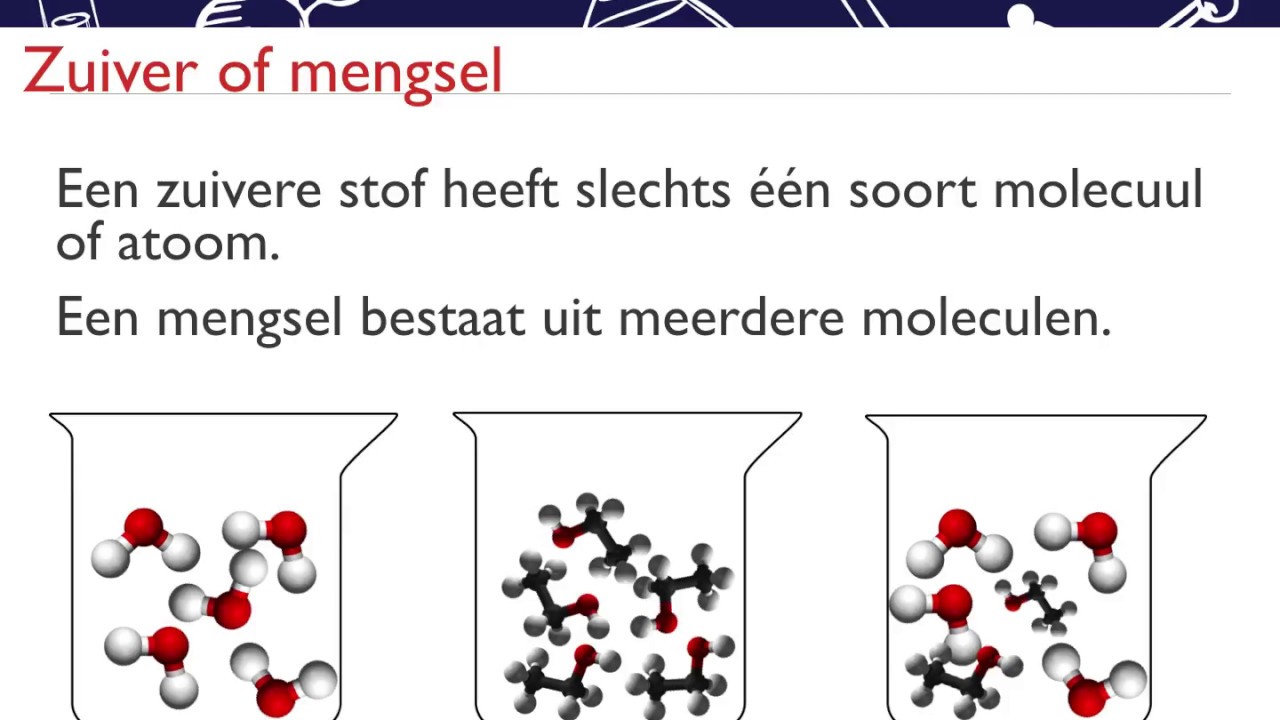
Een zuivere stof wordt in de scheikunde gedefinieerd als een substantie die bestaat uit slechts één type molecuul of atoom. Dit betekent dat de chemische samenstelling overal hetzelfde is en dat de stof niet verder kan worden gescheiden door fysische methoden, zoals filtratie of destillatie, zonder de chemische bindingen te verbreken. Denk hierbij aan elementen zoals goud (Au) of verbindingen zoals natriumchloride (NaCl), beter bekend als keukenzout.
Kenmerkend voor zuivere stoffen is dat ze constante fysische eigenschappen hebben, zoals een scherp smeltpunt en kookpunt. Deze eigenschappen zijn consistent en reproduceerbaar, ongeacht de herkomst van de zuivere stof.
Water: Een Simpele Molecule, Complexe Realiteit
Water, chemisch aangeduid als H₂O, bestaat uit twee waterstofatomen en één zuurstofatoom die covalent met elkaar verbonden zijn. In theorie zou je kunnen zeggen: ja, water is een zuivere stof, omdat het uitsluitend uit H₂O-moleculen bestaat.
Echter, de werkelijkheid is dat puur water, in de zin van enkel en alleen H₂O-moleculen zonder enige andere stoffen, zelden voorkomt in de natuur of in het dagelijks leven. Water is een uitstekend oplosmiddel en neemt daardoor gemakkelijk andere stoffen op. Deze opgeloste stoffen beïnvloeden de eigenschappen van het water.
Argumenten voor en tegen de Zuiverheid van Water
Argumenten Voor
Chemische Formule: De basisformule van water is H₂O. Dit wijst erop dat het een verbinding is die bestaat uit een specifiek type molecuul. In een ideaal scenario, zonder enige andere stoffen, zou water dus een zuivere stof zijn.
Synthese: Het is mogelijk om in een laboratorium ultra-puur water te synthetiseren door middel van processen zoals omgekeerde osmose, deïonisatie en destillatie. Dit water bevat minimale verontreinigingen en benadert de definitie van een zuivere stof.
Argumenten Tegen
Aanwezigheid van Ionen: Zelfs in zogenaamd 'puur' water komen altijd ionen voor, zoals H⁺ (protonen) en OH⁻ (hydroxide-ionen). Dit komt door de auto-ionisatie van water, een proces waarbij een klein deel van de watermoleculen spontaan dissocieert. Deze ionen beïnvloeden de pH-waarde en elektrische geleidbaarheid van het water.
Opgeloste Stoffen: Natuurlijk water, zoals regenwater, rivierwater of zeewater, bevat altijd opgeloste mineralen, gassen en organische stoffen. Deze stoffen zijn afkomstig uit de atmosfeer, de bodem en andere bronnen. Hierdoor is natuurlijk water technisch gezien een mengsel, geen zuivere stof.
Isotopen: Water bestaat niet alleen uit de meest voorkomende isotopen van waterstof (¹H) en zuurstof (¹⁶O). Er zijn ook zwaardere isotopen aanwezig, zoals deuterium (²H) en tritium (³H) voor waterstof en ¹⁷O en ¹⁸O voor zuurstof. Hoewel de chemische eigenschappen van water met verschillende isotopen vergelijkbaar zijn, zijn ze technisch gezien verschillende moleculen.
Real-World Voorbeelden en Data
Drinkwater: Drinkwater, hoewel gezuiverd, is geen zuivere stof. Het bevat mineralen zoals calcium en magnesium, die belangrijk zijn voor de gezondheid. De exacte samenstelling is gereguleerd door wetgeving om de veiligheid en kwaliteit te waarborgen.
Zeewater: Zeewater is een complex mengsel van water, zout (voornamelijk natriumchloride), mineralen en organische stoffen. De saliniteit (zoutgehalte) varieert afhankelijk van de locatie en de omstandigheden, wat aantoont dat het geen constante samenstelling heeft.
Laboratoriumwater: Laboratoria gebruiken verschillende gradaties van zuiver water, afhankelijk van de toepassing. Gedemineraliseerd water is bijvoorbeeld vrij van ionen, maar kan nog organische verontreinigingen bevatten. Ultra-puur water, gebruikt in gevoelige analyses, wordt geproduceerd door een combinatie van processen om alle verontreinigingen te minimaliseren. Zelfs dit ultra-puur water is echter niet perfect zuiver, omdat het nog steeds sporen van ionen en opgeloste gassen kan bevatten.
Data: De elektrische geleidbaarheid van ultra-puur water is extreem laag, vaak minder dan 0.055 μS/cm (microsiemens per centimeter). Dit geeft aan dat er zeer weinig ionen aanwezig zijn. Ter vergelijking: kraanwater heeft een geleidbaarheid van 50-800 μS/cm, afhankelijk van de herkomst en behandeling.
De Betekenis van de Context
Of water als een zuivere stof wordt beschouwd, hangt sterk af van de context. In een theoretische setting, waar we water beschouwen als uitsluitend H₂O-moleculen, kan het als een zuivere stof worden beschouwd. In de praktijk, in realistische scenario's, bevat water altijd wel een zekere mate van verontreinigingen en is het dus technisch gezien een mengsel.
Voor veel toepassingen, zoals het koken van water of het bewateren van planten, is de aanwezigheid van kleine hoeveelheden opgeloste stoffen irrelevant. Voor andere toepassingen, zoals in de chemische analyse of de productie van medicijnen, is het van cruciaal belang om water met een zeer hoge zuiverheid te gebruiken.
Conclusie
Samenvattend kunnen we stellen dat water (H₂O) in theorie een zuivere stof is, aangezien het bestaat uit één type molecuul. Echter, in de praktijk is water zelden, zo niet nooit, volledig zuiver vanwege de aanwezigheid van ionen, opgeloste stoffen en isotopen. De mate waarin water als 'zuiver' wordt beschouwd, is afhankelijk van de specifieke toepassing en de vereisten voor die toepassing.
Wat betekent dit voor jou? Denk kritisch na over de zuiverheid van water in verschillende situaties. Realiseer je dat 'puur' een relatief begrip is en dat de context bepalend is voor de relevantie van verontreinigingen. Of je nu een chemicus bent in een laboratorium of iemand die een glas water drinkt, het is belangrijk om je bewust te zijn van de complexiteit achter deze ogenschijnlijk eenvoudige molecule.
Volgende stap: Onderzoek de waterkwaliteit in jouw omgeving. Bekijk de samenstelling van kraanwater en vergelijk dit met de vereisten voor verschillende toepassingen. Leer meer over waterzuiveringstechnieken en hoe deze de kwaliteit van water beïnvloeden.
Bekijk ook deze gerelateerde berichten:
- Hoe Oud Is De Prins Van Sneeuwwitje
- Kleiner Dan Of Gelijk Aan
- Emmett Brown Back To The Future
- Film Hotel De Grote L
- Skelet Van Een Mens Met Namen
- Spider-man No Way Home Kijken Free
- Draait De Aarde Om De Maan
- Muziek Van Soldaat Van Oranje
- Hoe Oud Kan Een Tijger Worden
- Schrijver Van Het Leven Van Een Loser
