Hoe Bereken Je Molaire Massa

Heb je je ooit afgevraagd waarom scheikundigen zo obsessief zijn met die mysterieuze "molaire massa"? Het lijkt misschien een droge, theoretische aangelegenheid, maar geloof me, het is een essentiële sleutel tot het ontgrendelen van de chemische wereld. Van het perfect afmeten van ingrediënten voor een succesvolle reactie tot het begrijpen van de samenstelling van een onbekende stof, de molaire massa is je betrouwbare gids.
Laten we eerlijk zijn, scheikunde kan soms overweldigend aanvoelen. Al die formules en berekeningen... Maar maak je geen zorgen! Deze gids is ontworpen om je stap voor stap te helpen de molaire massa te begrijpen en te berekenen, zonder dat je een genie hoeft te zijn.
Wat is Molaire Massa precies?
De molaire massa is, in simpele bewoordingen, de massa van één mol van een stof. Een mol is een specifieke hoeveelheid, namelijk 6.022 x 1023 deeltjes (atomen, moleculen, ionen, etc.). Dit getal staat bekend als de constante van Avogadro. Denk aan een mol als een soort "chemisch dozijn".
De molaire massa wordt meestal uitgedrukt in gram per mol (g/mol). Het vertelt je dus hoeveel gram een mol van een bepaalde stof weegt.
Waarom is dit belangrijk? Omdat het ons in staat stelt om massa (wat we kunnen wegen) te relateren aan de hoeveelheid stof (het aantal deeltjes). Dit is cruciaal voor het uitvoeren van nauwkeurige chemische reacties en analyses.
Hoe vind je de Molaire Massa?
Gelukkig hoef je de molaire massa niet uit het hoofd te leren voor elke stof die je tegenkomt. Je kunt het vinden op het periodiek systeem der elementen! Elk element heeft een atoommassa, die onder het symbool van het element staat vermeld. Deze atoommassa, uitgedrukt in atomaire massa-eenheden (amu), is numeriek gelijk aan de molaire massa in gram per mol.
Bijvoorbeeld, de atoommassa van koolstof (C) is ongeveer 12.01 amu. Dus, de molaire massa van koolstof is 12.01 g/mol.
Molaire Massa van Elementen: Een Eenvoudige Start
Het berekenen van de molaire massa van een enkel element is dus heel simpel: je zoekt de atoommassa op in het periodiek systeem en voegt de eenheid "g/mol" toe.
Voorbeelden:
- Waterstof (H): 1.01 g/mol
- Zuurstof (O): 16.00 g/mol
- Natrium (Na): 22.99 g/mol
- Chloor (Cl): 35.45 g/mol
Molaire Massa van Moleculen en Verbindingen: Stap voor Stap
De zaken worden iets interessanter als we de molaire massa van moleculen (bijv. water, H2O) of ionische verbindingen (bijv. natriumchloride, NaCl) willen berekenen. Maar maak je geen zorgen, het is nog steeds beheersbaar! Volg deze stappen:
- Identificeer de chemische formule: Zorg ervoor dat je de juiste chemische formule van de stof kent. Dit geeft aan welke elementen aanwezig zijn en in welke verhouding.
- Zoek de atoommassa's op: Raadpleeg het periodiek systeem en noteer de atoommassa's van alle elementen in de formule.
- Vermenigvuldig met het aantal atomen: Vermenigvuldig de atoommassa van elk element met het aantal keren dat het element voorkomt in de formule.
- Tel alles bij elkaar op: Tel alle vermenigvuldigde atoommassa's bij elkaar op. Het resultaat is de molaire massa van de verbinding in g/mol.
Voorbeelden van Moleculaire Massa Berekeningen
Laten we een paar voorbeelden bekijken om het duidelijker te maken:
Voorbeeld 1: Water (H2O)
- Formule: H2O
- Atoommassa van waterstof (H): 1.01 g/mol
- Atoommassa van zuurstof (O): 16.00 g/mol
- Berekening: (2 x 1.01 g/mol) + (1 x 16.00 g/mol) = 18.02 g/mol
- Dus, de molaire massa van water is 18.02 g/mol.
Voorbeeld 2: Natriumchloride (NaCl)
- Formule: NaCl
- Atoommassa van natrium (Na): 22.99 g/mol
- Atoommassa van chloor (Cl): 35.45 g/mol
- Berekening: (1 x 22.99 g/mol) + (1 x 35.45 g/mol) = 58.44 g/mol
- Dus, de molaire massa van natriumchloride is 58.44 g/mol.
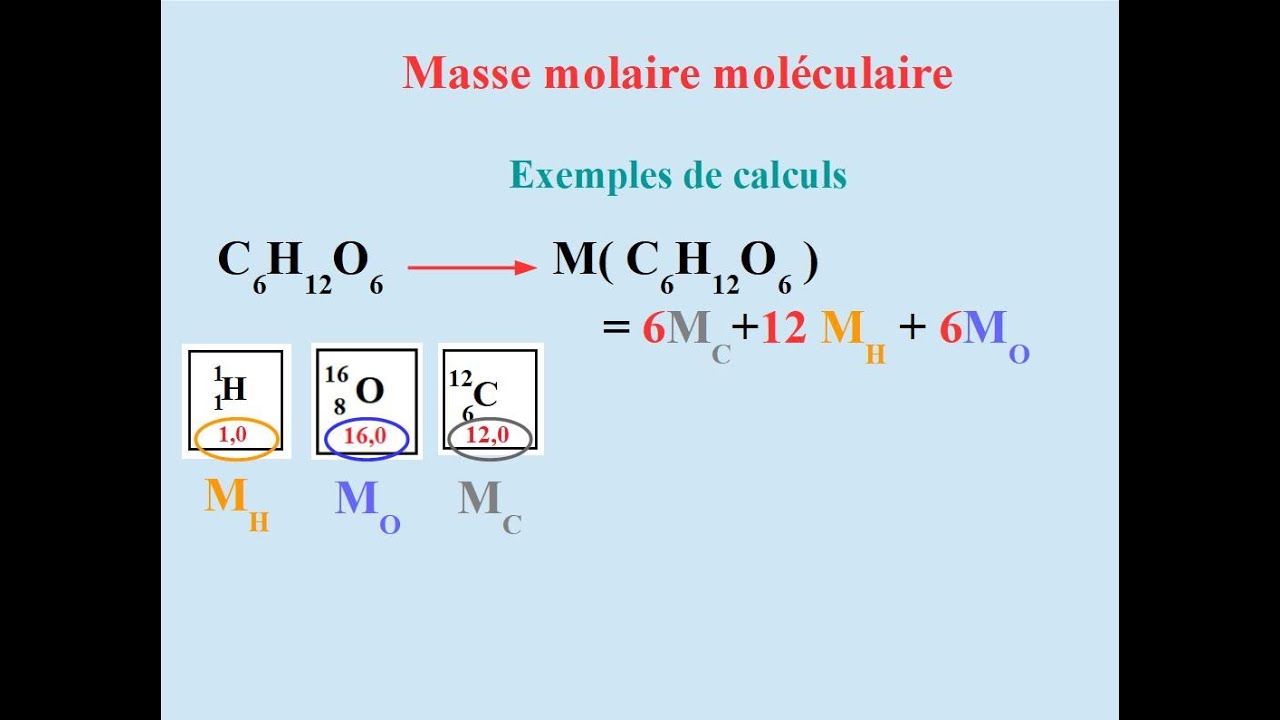
Voorbeeld 3: Glucose (C6H12O6)
- Formule: C6H12O6
- Atoommassa van koolstof (C): 12.01 g/mol
- Atoommassa van waterstof (H): 1.01 g/mol
- Atoommassa van zuurstof (O): 16.00 g/mol
- Berekening: (6 x 12.01 g/mol) + (12 x 1.01 g/mol) + (6 x 16.00 g/mol) = 180.18 g/mol
- Dus, de molaire massa van glucose is 180.18 g/mol.
Waarom is dit Nuttig?
De molaire massa is een cruciaal hulpmiddel in de scheikunde. Hier zijn een paar voorbeelden van waar het voor gebruikt wordt:
- Stoichiometrie: Het berekenen van de hoeveelheden reactanten en producten die nodig zijn in een chemische reactie. Dit is essentieel voor het optimaliseren van reacties en het maximaliseren van de opbrengst.
- Concentratiebepaling: Het berekenen van de concentratie van een oplossing (bijv. molariteit).
- Omrekenen van massa naar mol: Het omrekenen van de massa van een stof naar het aantal mol, of omgekeerd. Dit is belangrijk bij het afwegen van reactanten.
- Analyse van onbekende stoffen: Het bepalen van de identiteit van een onbekende stof door de molaire massa te meten en te vergelijken met bekende waarden.
Praktische Tips & Tricks
- Wees nauwkeurig: Gebruik de meest nauwkeurige atoommassa's die beschikbaar zijn. Meestal zijn dit de waarden die op het periodiek systeem staan vermeld.
- Let op afronding: Rond de atoommassa's niet te vroeg af. Dit kan leiden tot significante fouten in de uiteindelijke molaire massa. Rond pas af aan het einde van de berekening.
- Controleer je werk: Dubbelcheck je berekeningen om fouten te voorkomen.
- Gebruik een rekenmachine: Een rekenmachine met wetenschappelijke functies is essentieel voor het uitvoeren van deze berekeningen.
- Online calculators: Er zijn veel online molaire massa calculators beschikbaar. Deze kunnen handig zijn om je antwoorden te controleren of om de molaire massa van complexe moleculen te berekenen.
Conclusie
De molaire massa is een fundamenteel concept in de scheikunde. Door te begrijpen hoe je het moet berekenen, kun je de hoeveelheden van stoffen bepalen en voorspellen, en zo de chemische wereld om je heen beter begrijpen. Hoewel het in eerste instantie intimiderend kan lijken, is het met de juiste stappen en oefening zeker te beheersen. Dus, pak je periodiek systeem, rekenmachine en begin met oefenen! Je zult versteld staan van wat je kunt bereiken!
Onthoud: chemie is niet eng, het is gewoon een kwestie van begrijpen van de basisprincipes. Veel succes!

Bekijk ook deze gerelateerde berichten:
- In Welke Gebieden Komt Parkinson Voor
- Tot Wanneer Is Een Koortslip Besmettelijk
- De Eindtijd Wat Gaat Er Gebeuren
- De Waarde Van Het Woord Extra
- Formule Voor Rente Op Rente
- Hoeveel Eetlepels Is 50 Gram Havermout
- Cito Leerling In Beeld Contact
- Wanneer Begint De Zomervakantie Midden Nederland
- Is Zondag De Eerste Dag Van De Week
- Hoe Lang Geleden Leefde Dinos
