Hoe Herken Je Een Redoxreactie
Heb je je ooit afgevraagd hoe je telefoonbatterij energie levert, of hoe roest op metaal verschijnt? Achter deze alledaagse fenomenen schuilt een fascinerend chemisch proces: de redoxreactie. Misschien klinkt het ingewikkeld, maar geloof me, met een beetje uitleg is het prima te begrijpen. Veel mensen vinden scheikunde lastig, en redoxreacties lijken vaak een struikelblok. Maar geen zorgen! Dit artikel is jouw gids om redoxreacties te herkennen en te begrijpen, zodat je ze in de toekomst met vertrouwen kunt identificeren.
Wat is een Redoxreactie Eigenlijk?
Laten we beginnen met de basis. Een redoxreactie is simpelweg een reactie waarbij elektronen worden uitgewisseld tussen twee stoffen. De term "redox" is een samentrekking van reductie en oxidatie. Het is essentieel om te onthouden dat deze twee processen altijd hand in hand gaan. Je kunt het zien als een soort chemische 'give and take'.
Oxidatie: Elektronen Afstaan
Oxidatie is het proces waarbij een stof elektronen afstaat. Stel je voor: een atoom "geeft" een negatief geladen elektron weg. Hierdoor wordt het atoom zelf positiever (of minder negatief) in lading. Een handige manier om dit te onthouden is de afkorting OIL: Oxidation Is Loss (of electrons).
Reductie: Elektronen Opnemen
Reductie is het tegenovergestelde van oxidatie. Hierbij neemt een stof elektronen op. Het atoom dat een elektron ontvangt, wordt negatiever (of minder positief) in lading. En om het makkelijk te maken: RIG: Reduction Is Gain (of electrons).
Denk eraan: er kan geen oxidatie plaatsvinden zonder reductie, en vice versa. Het zijn twee kanten van dezelfde medaille.
Hoe Herken Je een Redoxreactie?
Nu komt de cruciale vraag: hoe spot je een redoxreactie? Hier zijn een paar belangrijke aanwijzingen waar je op kunt letten:
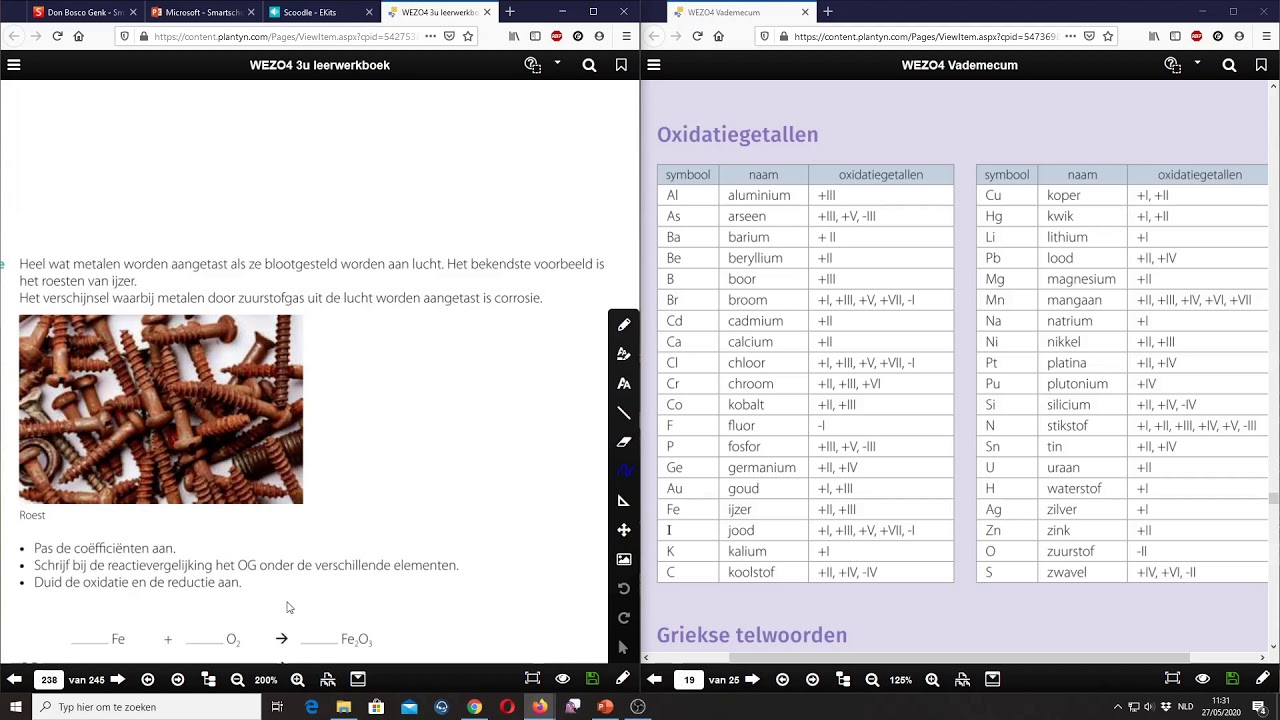
1. Verandering in Oxidatiegetallen
De meest betrouwbare manier om een redoxreactie te identificeren is door te kijken naar de oxidatiegetallen van de atomen in de reactie. Het oxidatiegetal is een fictieve lading die een atoom zou hebben als alle bindingen ionisch zouden zijn. Als het oxidatiegetal van een atoom verandert tijdens de reactie, dan is er sprake van een redoxreactie.
Hoe bepaal je oxidatiegetallen? Dit is een apart onderwerp, maar hier zijn een paar basisregels:
* Het oxidatiegetal van een element in zijn elementaire vorm is altijd 0 (bijvoorbeeld, O2, Fe, Cu). * Het oxidatiegetal van een monoatomisch ion is gelijk aan zijn lading (bijvoorbeeld, Na+ heeft een oxidatiegetal van +1, Cl- heeft een oxidatiegetal van -1). * Zuurstof heeft meestal een oxidatiegetal van -2 (behalve in peroxiden, zoals H2O2, waar het -1 is). * Waterstof heeft meestal een oxidatiegetal van +1 (behalve in metaalhydriden, zoals NaH, waar het -1 is). * De som van de oxidatiegetallen in een neutrale verbinding is 0. * De som van de oxidatiegetallen in een polyatomisch ion is gelijk aan de lading van het ion.Voorbeeld:
Neem de reactie: Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
* Zn(s) heeft een oxidatiegetal van 0. * Cu2+(aq) heeft een oxidatiegetal van +2. * Zn2+(aq) heeft een oxidatiegetal van +2. * Cu(s) heeft een oxidatiegetal van 0.Je ziet dat het oxidatiegetal van zink toeneemt van 0 naar +2 (oxidatie), en het oxidatiegetal van koper afneemt van +2 naar 0 (reductie). Dit is dus een duidelijke redoxreactie.
2. Reactie met Zuurstof (Verbranding)
Verbrandingsreacties zijn een veelvoorkomend type redoxreactie. Bij verbranding reageert een stof snel met zuurstof (O2), waarbij warmte en licht vrijkomen. Omdat zuurstof bijna altijd een oxidatiegetal van -2 krijgt tijdens zo'n reactie, en andere elementen hun getal verliezen, is verbranding een redelijke indicatie van een redoxreactie. Denk aan het verbranden van hout, aardgas, of benzine. In al deze gevallen reageren koolwaterstoffen met zuurstof, waarbij kooldioxide en water ontstaan.
Voorbeeld:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
Dit is de verbranding van methaan (aardgas). Zuurstof (O2) oxideert het methaan, en zelf wordt het gereduceerd. Dit is een klassieke redoxreactie.
3. Reacties met Metalen
Reacties waarbij metalen betrokken zijn, zijn vaak redoxreacties. Metalen hebben de neiging om elektronen af te staan en positieve ionen te vormen. Wanneer een metaal reageert met een andere stof, zoals een zuur of een metaalzout, is er vaak een uitwisseling van elektronen.
Voorbeeld:
Fe(s) + 2HCl(aq) → FeCl2(aq) + H2(g)
Hier reageert ijzer met zoutzuur. Het ijzer wordt geoxideerd tot ijzer(II)chloride, en waterstofionen worden gereduceerd tot waterstofgas. Weer een voorbeeld van een redoxreactie.
4. Elektrolyse
Elektrolyse is het proces waarbij een elektrische stroom wordt gebruikt om een chemische reactie te forceren die normaal gesproken niet spontaan zou verlopen. Elektrolyse wordt vaak gebruikt om stoffen te ontleden, zoals water (in waterstof en zuurstof) of gesmolten zouten (in hun elementen). Elektrolyse is altijd een redoxreactie, omdat er elektronen worden overgedragen bij de elektroden.
Voorbeeld:
Elektrolyse van water: 2H2O(l) → 2H2(g) + O2(g)
Hier wordt water ontleed in waterstofgas en zuurstofgas met behulp van elektrische energie. Dit is een redoxreactie waarbij water wordt geoxideerd tot zuurstof, en water wordt gereduceerd tot waterstof.
5. Reacties met Oxiderende en Reducerende Middelen
Sommige stoffen staan bekend als oxiderende middelen of reducerende middelen. Een oxiderend middel is een stof die een andere stof oxideert (d.w.z., elektronen ontneemt). Zelf wordt het oxiderend middel gereduceerd. Een reducerend middel is een stof die een andere stof reduceert (d.w.z., elektronen geeft). Zelf wordt het reducerend middel geoxideerd.
Bekende oxiderende middelen zijn zuurstof (O2), chloor (Cl2), kaliumpermanganaat (KMnO4), en salpeterzuur (HNO3). Bekende reducerende middelen zijn waterstof (H2), koolstofmonoxide (CO), en metalen zoals natrium (Na) en magnesium (Mg).
Als je een reactie ziet met een bekend oxiderend of reducerend middel, is de kans groot dat het een redoxreactie is.
Waarom zijn Redoxreacties Belangrijk?
Redoxreacties zijn essentieel voor het leven en de technologie. Ze spelen een rol in tal van processen, waaronder:
* Ademhaling: In onze cellen worden glucose en zuurstof omgezet in energie, kooldioxide en water door een reeks redoxreacties. * Fotosynthese: Planten gebruiken zonlicht om kooldioxide en water om te zetten in glucose en zuurstof, ook een redoxproces. * Batterijen: Batterijen werken op basis van redoxreacties om elektrische energie te leveren. * Corrosie: Roest is een voorbeeld van een redoxreactie waarbij ijzer reageert met zuurstof en water. * Industriële processen: Veel industriële processen, zoals de productie van metalen, plastics en chemicaliën, zijn gebaseerd op redoxreacties.Tips om Redoxreacties te Herkennen
Om je te helpen redoxreacties te herkennen, volgen hier nog een paar praktische tips:
* Oefen, oefen, oefen: Hoe meer reacties je analyseert, hoe beter je erin wordt. * Gebruik oxidatiegetallen: Dit is de meest betrouwbare methode. * Let op bekende oxiderende en reducerende middelen: Hun aanwezigheid is een sterke aanwijzing. * Denk aan verbranding: Verbrandingsreacties zijn bijna altijd redoxreacties. * Wees alert op reacties met metalen: Metalen zijn vaak betrokken bij redoxreacties.Redoxreacties zijn overal om ons heen, van de energieproductie in ons lichaam tot de roestvorming op een oude fiets. Door de principes van oxidatie en reductie te begrijpen, kun je een dieper inzicht krijgen in de chemische processen die onze wereld vormgeven. Hopelijk geeft dit artikel je de nodige tools om deze fascinerende reacties te herkennen en te begrijpen!

Bekijk ook deze gerelateerde berichten:
- Hoe Zwaar Is Een Kogel Bij Kogelslingeren
- Mag Je Een Koran Verbranden
- Meneer Van Dalen Wacht Op Antwoord
- Hoe Vind Ik Een Onderwerp
- Hoe Start Je Een Conclusie
- Hoe Wordt Een Mannetjesvis Genoemd
- Is Een 5 5 Een Voldoende
- Hoeveel Gram Is 200 Ml
- Hoe Lang Duurt Afrijden Met Auto
- Hoe Lang Leeft Een Wesp Zonder Eten
