Hoe Weet Je Hoeveel Elektronen Een Atoom Heeft
Heb je je ooit afgevraagd waaruit alles om ons heen is opgebouwd? Het antwoord ligt in de atomen, de basisbouwstenen van alle materie. En binnen die atomen bevinden zich elektronen, minuscule deeltjes die een cruciale rol spelen in de chemische eigenschappen van elk element. Maar hoe weet je nu eigenlijk hoeveel elektronen een atoom heeft? Dit artikel is speciaal geschreven voor iedereen die geïnteresseerd is in scheikunde, van middelbare scholieren tot hobbyisten, en legt op een heldere en begrijpelijke manier uit hoe je dit kunt bepalen.
Het Periodiek Systeem: Je Belangrijkste Hulpmiddel
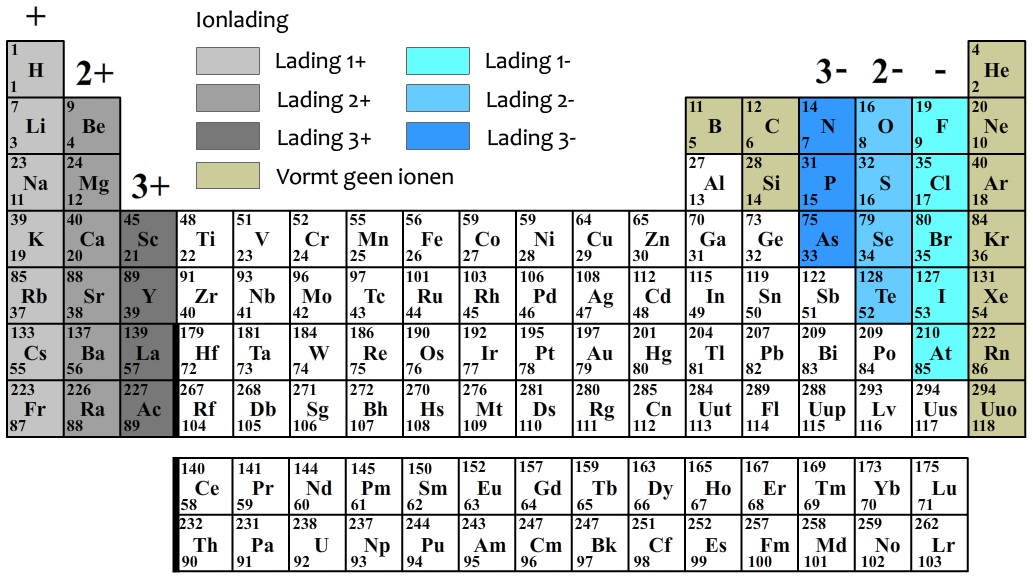
Het periodiek systeem der elementen is dé onmisbare tool als het gaat om het bepalen van het aantal elektronen in een atoom. Zie het als een soort landkaart die alle bekende elementen ordent op basis van hun atoomstructuur. En die structuur, daar draait het allemaal om.
Het Atoomnummer: De Sleutel tot het Aantal Elektronen
Elk element in het periodiek systeem heeft een uniek atoomnummer. Dit nummer, vaak linksboven in het vakje van het element te vinden, vertelt je precies hoeveel protonen er in de kern van een atoom van dat element zitten. Maar wat heeft dat nu met elektronen te maken?
Simpel: in een neutraal atoom is het aantal protonen gelijk aan het aantal elektronen. Een neutraal atoom heeft geen elektrische lading, omdat de positieve lading van de protonen precies wordt gecompenseerd door de negatieve lading van de elektronen. Dus, als je het atoomnummer van een element weet, weet je ook hoeveel elektronen een neutraal atoom van dat element heeft!
Laten we een paar voorbeelden bekijken:
- Waterstof (H): Heeft een atoomnummer van 1. Dit betekent dat een neutraal waterstofatoom 1 proton en dus ook 1 elektron heeft.
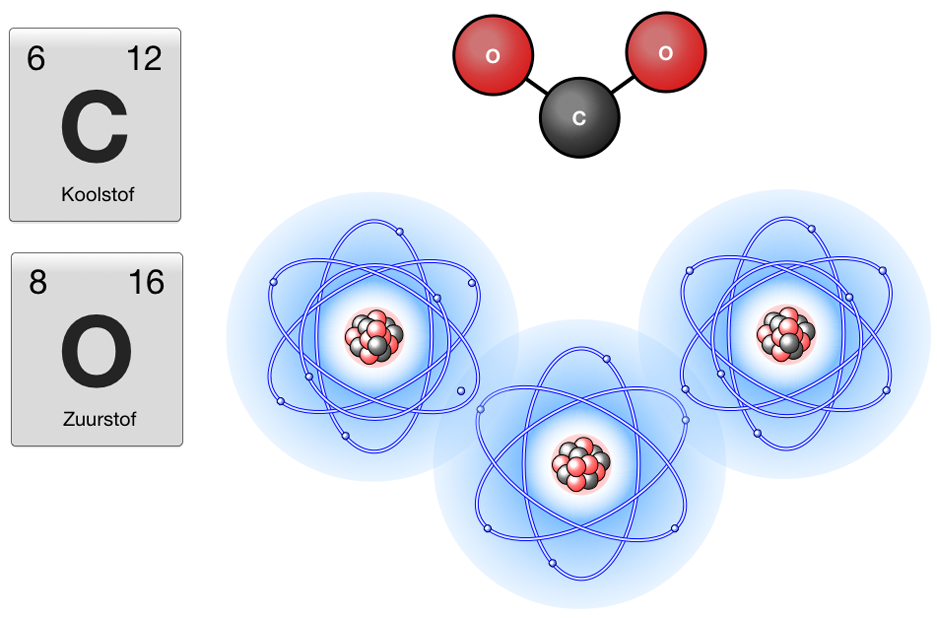
- Zuurstof (O): Heeft een atoomnummer van 8. Een neutraal zuurstofatoom heeft dus 8 protonen en 8 elektronen.
- Natrium (Na): Heeft een atoomnummer van 11. Een neutraal natriumatoom heeft 11 protonen en 11 elektronen.
Zo zie je hoe gemakkelijk het is om het aantal elektronen te bepalen aan de hand van het periodiek systeem. Maar er is een 'maar'...
Ionen: Wanneer de Regel Niet Opgaat
De regel "atoomnummer = aantal elektronen" geldt alleen voor neutrale atomen. Atomen kunnen echter ook elektronen verliezen of opnemen, waardoor ze een lading krijgen. Deze geladen atomen noemen we ionen.
Er zijn twee soorten ionen:
- Positieve ionen (kationen): Ontstaan wanneer een atoom één of meer elektronen verliest. Omdat er nu meer protonen dan elektronen zijn, heeft het ion een positieve lading.
- Negatieve ionen (anionen): Ontstaan wanneer een atoom één of meer elektronen opneemt. Er zijn nu meer elektronen dan protonen, waardoor het ion een negatieve lading heeft.
Hoe bepaal je nu het aantal elektronen in een ion?
Hier is de formule:
Aantal elektronen in een ion = Atoomnummer - Lading van het ion
Laten we weer een paar voorbeelden bekijken:
- Na+ (Natrium-ion): Natrium heeft een atoomnummer van 11. Het ion heeft een lading van +1, wat betekent dat het één elektron heeft verloren. Dus: 11 - (+1) = 10 elektronen.
- Cl- (Chloride-ion): Chloor heeft een atoomnummer van 17. Het ion heeft een lading van -1, wat betekent dat het één elektron heeft opgenomen. Dus: 17 - (-1) = 18 elektronen.
- O2- (Oxide-ion): Zuurstof heeft een atoomnummer van 8. Het ion heeft een lading van -2, wat betekent dat het twee elektronen heeft opgenomen. Dus: 8 - (-2) = 10 elektronen.
Let goed op de lading van het ion! Een positieve lading betekent dat je het aantal elektronen moet verminderen, terwijl een negatieve lading betekent dat je het aantal elektronen moet vermeerderen.
Elektronenconfiguratie: Waar Bevinden Zich de Elektronen?
Niet alleen hoeveel elektronen een atoom heeft is belangrijk, maar ook waar ze zich bevinden. Elektronen bewegen zich niet willekeurig rond de atoomkern. Ze bezetten specifieke energieniveaus en orbitalen.
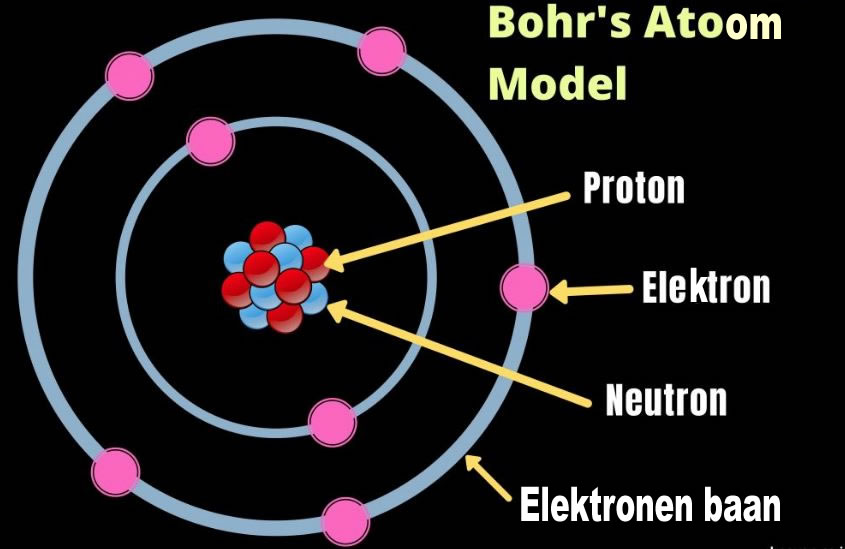
Stel je de atoomkern voor als de zon, en de elektronen als planeten die in verschillende banen rond de zon draaien. Deze banen zijn de energieniveaus, ook wel schillen genoemd. Elke schil kan een bepaald maximum aantal elektronen bevatten:
- De eerste schil (K-schil) kan maximaal 2 elektronen bevatten.
- De tweede schil (L-schil) kan maximaal 8 elektronen bevatten.
- De derde schil (M-schil) kan maximaal 18 elektronen bevatten.
- De vierde schil (N-schil) kan maximaal 32 elektronen bevatten.
- Enzovoort...
Binnen elke schil bevinden zich orbitalen. Dit zijn ruimtelijke gebieden waar de kans het grootst is om een elektron aan te treffen. Er zijn verschillende soorten orbitalen, die worden aangeduid met de letters s, p, d en f:
- s-orbitalen: Zijn bolvormig en kunnen maximaal 2 elektronen bevatten.
- p-orbitalen: Zijn haltervormig en er zijn er drie per energieniveau, waardoor ze maximaal 6 elektronen kunnen bevatten.
- d-orbitalen: Hebben complexere vormen en er zijn er vijf per energieniveau, waardoor ze maximaal 10 elektronen kunnen bevatten.
- f-orbitalen: Zijn nog complexer en er zijn er zeven per energieniveau, waardoor ze maximaal 14 elektronen kunnen bevatten.
De manier waarop de elektronen over de verschillende schillen en orbitalen zijn verdeeld, noemen we de elektronenconfiguratie. Deze configuratie bepaalt grotendeels de chemische eigenschappen van een element.
Het opschrijven van de elektronenconfiguratie kan in eerste instantie ingewikkeld lijken, maar er zijn bepaalde regels en patronen die je kunt volgen. Een belangrijke regel is het aufbau-principe, dat stelt dat elektronen eerst de laagste beschikbare energieniveaus vullen voordat ze naar hogere niveaus gaan.
Hier zijn een paar voorbeelden van elektronenconfiguraties:
- Waterstof (H): 1s1 (1 elektron in de 1s-orbitaal)
- Helium (He): 1s2 (2 elektronen in de 1s-orbitaal)
- Lithium (Li): 1s2 2s1 (2 elektronen in de 1s-orbitaal en 1 elektron in de 2s-orbitaal)
- Zuurstof (O): 1s2 2s2 2p4 (2 elektronen in de 1s-orbitaal, 2 elektronen in de 2s-orbitaal en 4 elektronen in de 2p-orbitalen)
Het begrijpen van elektronenconfiguraties helpt je te begrijpen waarom elementen bepaalde verbindingen vormen en waarom ze bepaalde chemische eigenschappen vertonen. Het is een fundamenteel concept in de chemie.
Waarom is Dit Belangrijk?
Weten hoeveel elektronen een atoom heeft is cruciaal voor het begrijpen van de basisprincipes van de chemie. Het stelt je in staat om:
- De reactiviteit van elementen te voorspellen: Elementen met een complete buitenste schil (edelgassen) zijn bijvoorbeeld zeer stabiel en reageren nauwelijks met andere elementen. Elementen met een bijna complete of bijna lege buitenste schil zijn daarentegen zeer reactief.
- Chemische bindingen te begrijpen: De interactie tussen elektronen van verschillende atomen bepaalt hoe chemische bindingen worden gevormd. Weten hoeveel elektronen er beschikbaar zijn, helpt je te begrijpen welke soorten bindingen mogelijk zijn.
- De eigenschappen van stoffen te verklaren: De manier waarop atomen zijn gerangschikt en verbonden, en de manier waarop hun elektronen interageren, bepalen de fysische en chemische eigenschappen van stoffen, zoals smeltpunt, kookpunt, geleidbaarheid en reactiviteit.
Kortom, het begrijpen van de elektronische structuur van atomen is essentieel voor het begrijpen van de wereld om ons heen. Het is de basis waarop de hele chemie is gebouwd.
Conclusie: Kennis is Macht (en Begrip!)
We hebben gezien hoe je het aantal elektronen in een atoom kunt bepalen met behulp van het periodiek systeem. We hebben geleerd dat het atoomnummer de sleutel is, en dat je rekening moet houden met de lading als het om ionen gaat. We hebben ook kort gekeken naar de elektronenconfiguratie en hoe elektronen zich gedragen binnen de atoomstructuur.
Door deze kennis op te doen, heb je een belangrijke stap gezet in het begrijpen van de chemie. Blijf nieuwsgierig, blijf vragen stellen en blijf leren! De wereld van de atomen en moleculen is fascinerend en er is altijd iets nieuws te ontdekken. Dus pak je periodiek systeem erbij en begin met ontdekken!
Bekijk ook deze gerelateerde berichten:
- Hoeveel Weken Tot De Zomer
- Wat Zegt De Bijbel Over Psychose
- Brandweer Camper Van Kees Aantjes
- Hoeveel Procent Is Moslim In Nederland
- Rekenen Mbo Niveau 4 Oefenen
- Hoe Schrijf Je Diploma Uitreiking
- Komma Voor Of Achter Maar
- Halleluja Lof Zij Het Lam
- Ds De Pater Ger Gem Afgezet
- Wanneer Begint De Slimste Mens 2023/2024
