Hoe Weet Je Of Een Reactie Endotherm Of Exotherm Is
Heb je je ooit afgevraagd waarom je handen koud worden als je een ijspak vasthoudt? Of waarom een vuur zo heerlijk warm aanvoelt? Achter deze alledaagse ervaringen schuilt een fascinerend stukje scheikunde: de wereld van endotherme en exotherme reacties. Als je scheikunde studeert, of gewoon nieuwsgierig bent naar de wereld om je heen, kan het begrijpen van deze reacties je helpen de energieveranderingen in allerlei processen te verklaren.
Het kan in het begin wat verwarrend zijn. Begrippen als enthalpie en energie-overdracht kunnen intimiderend klinken. Maar geen zorgen, we gaan het stap voor stap uitleggen. Het doel is om je een helder beeld te geven van hoe je een endotherme of exotherme reactie kunt herkennen, en waarom dat belangrijk is.
Wat zijn Endotherme en Exotherme Reacties?
Laten we beginnen met de basis. Chemische reacties zijn in essentie het herschikken van atomen en moleculen. Tijdens dit proces wordt energie opgenomen of vrijgegeven. Dat is waar endotherme en exotherme reacties om de hoek komen kijken.
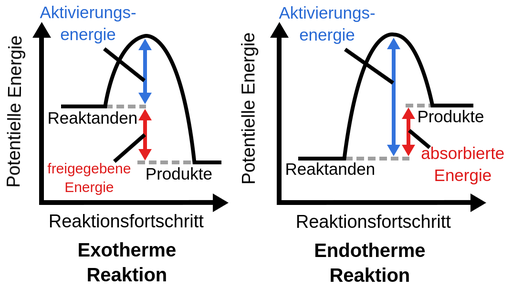
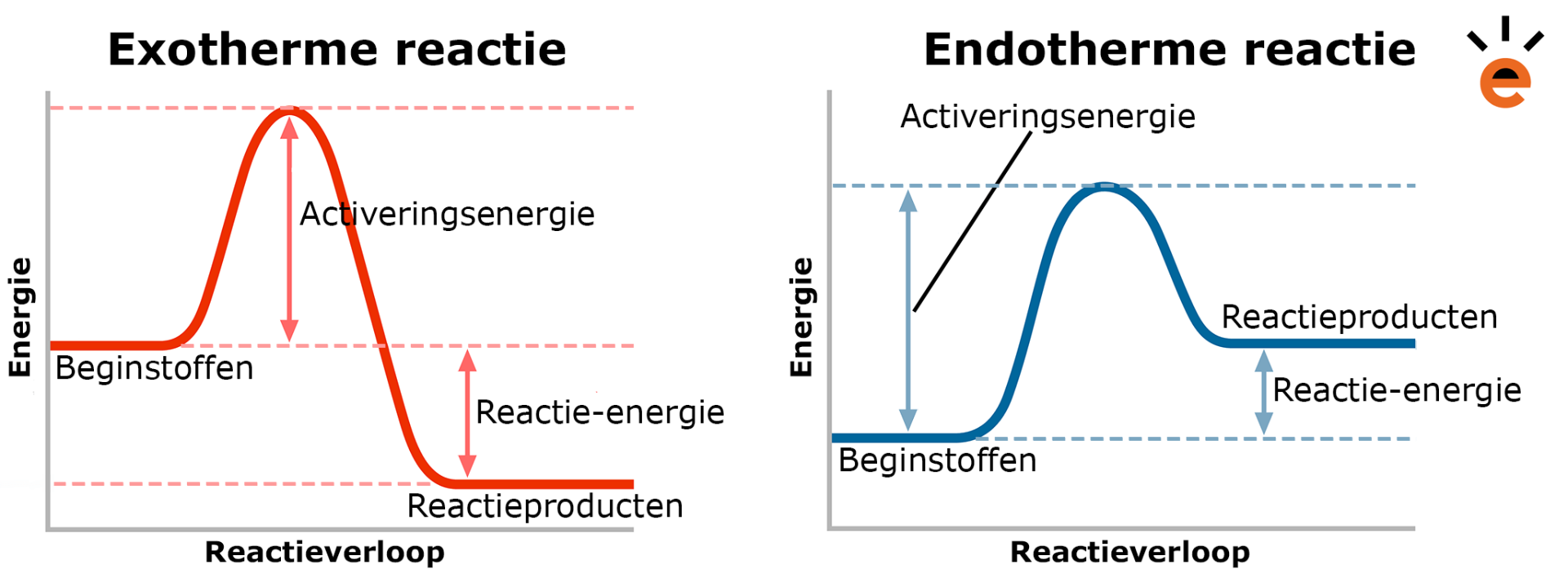
- Exotherme reacties: Dit zijn reacties die warmte afgeven aan de omgeving. Denk aan een brandend stuk hout, of de explosie van vuurwerk. De energie van de producten is lager dan de energie van de reagentia, het 'overschot' komt vrij als warmte.
- Endotherme reacties: Dit zijn reacties die warmte uit de omgeving opnemen. Denk aan het smelten van ijs, of het koken van water. De energie van de producten is hoger dan de energie van de reagentia, de benodigde energie wordt uit de omgeving gehaald.
Het is belangrijk te onthouden dat "warmte" hier niet alleen letterlijke hitte betekent, maar ook andere vormen van energie, zoals licht.
Hoe Herken Je Een Endotherme of Exotherme Reactie?
Er zijn verschillende manieren om te bepalen of een reactie endotherm of exotherm is. Laten we er een paar bekijken:
1. Temperatuurverandering
Dit is misschien wel de meest directe manier. Meet de temperatuur van de omgeving *voor* en *na* de reactie.
- Exotherme reactie: De temperatuur van de omgeving stijgt. Je voelt warmte.
- Endotherme reactie: De temperatuur van de omgeving daalt. Je voelt kou.
Voorbeeld: Als je azijn met baking soda mengt (een endotherme reactie), zul je merken dat het mengsel kouder wordt.
2. Enthalpieverandering (ΔH)
Enthalpie is een thermodynamische eigenschap die de totale warmte-inhoud van een systeem weergeeft. De verandering in enthalpie (ΔH) geeft de warmte die is opgenomen of vrijgegeven tijdens een reactie bij constante druk.
- Exotherme reactie: ΔH is negatief (ΔH < 0). Dit betekent dat energie is vrijgekomen.
- Endotherme reactie: ΔH is positief (ΔH > 0). Dit betekent dat energie is opgenomen.
Voorbeeld: Voor de verbranding van methaan (een exotherme reactie) is ΔH ongeveer -890 kJ/mol. De minteken geeft aan dat er energie vrijkomt.
3. Observeren van Energie Input of Output
Soms is het duidelijk dat een reactie energie nodig heeft om te starten of dat er energie vrijkomt in de vorm van licht of geluid.
- Endotherme reactie: Vereist continue toevoer van energie (bijvoorbeeld warmte) om te blijven verlopen. Denk aan het constant verwarmen van water om het te laten koken.
- Exotherme reactie: Kan spontaan verlopen nadat het eenmaal is gestart, en produceert energie (bijvoorbeeld een explosie).
4. Kijken naar de chemische vergelijking
In een chemische vergelijking kan energie (warmte) worden weergegeven als een reactant of een product.
- Endotherme reactie: Energie (warmte) wordt aan de linkerzijde van de vergelijking weergegeven (als een reactant). Bijvoorbeeld: N2 + O2 + warmte → 2NO
- Exotherme reactie: Energie (warmte) wordt aan de rechterzijde van de vergelijking weergegeven (als een product). Bijvoorbeeld: CH4 + 2O2 → CO2 + 2H2O + warmte
Voorbeelden in het Dagelijks Leven
Endotherme en exotherme reacties zijn overal om ons heen. Laten we eens kijken naar een paar voorbeelden:
- Ademhaling (exotherm): Je lichaam verbrandt glucose (suiker) om energie te produceren. Dit is een exotherm proces dat warmte genereert, waardoor je lichaamstemperatuur constant blijft.
- Fotosynthese (endotherm): Planten gebruiken zonlicht (energie) om koolstofdioxide en water om te zetten in glucose en zuurstof. Dit is een endotherm proces.
- Instant Ice Packs (endotherm): Deze bevatten chemicaliën die, wanneer ze gemengd worden, een endotherme reactie veroorzaken, waardoor het pak koud wordt.
- Verbranding van Brandstoffen (exotherm): Het verbranden van benzine, hout of gas is een exotherm proces dat warmte en licht produceert.
Mogelijke Verwarringen en Tegenargumenten
Soms kan het lastig zijn om een reactie te categoriseren. Bijvoorbeeld:
- Activeringsenergie: Elke reactie heeft activeringsenergie nodig om op gang te komen. Zelfs exotherme reacties hebben een "vonkje" nodig. Dit betekent *niet* dat de reactie endotherm is. De activeringsenergie is slechts een drempel die overwonnen moet worden.
- Schijnbare tegenstrijdigheden: Sommige reacties kunnen in eerste instantie warmte opnemen, maar uiteindelijk toch warmte afgeven (of omgekeerd). Dit komt door complexere processen die plaatsvinden. De *netto* energieverandering bepaalt of de reactie uiteindelijk endotherm of exotherm is.
Sommige mensen beweren dat het labelen van reacties als "endotherm" of "exotherm" simplistisch is en de complexiteit van chemische processen negeert. Hoewel het waar is dat de werkelijkheid complexer kan zijn, is deze classificatie een nuttig hulpmiddel om de basisprincipes van energieoverdracht te begrijpen. Het biedt een fundamenteel begrip dat verder kan worden uitgebreid met meer geavanceerde concepten.
Waarom is dit Belangrijk?
Het begrijpen van endotherme en exotherme reacties is cruciaal in veel gebieden:
- Energieproductie: Inzicht in verbrandingsprocessen is essentieel voor het ontwikkelen van efficiëntere energiebronnen.
- Nieuwe materialen: Bij het ontwerpen van nieuwe materialen is het belangrijk te weten hoe ze reageren op warmte en koude.
- Industriële processen: Veel industriële processen, zoals de productie van kunstmest en plastic, maken gebruik van gecontroleerde endotherme en exotherme reacties.
- Voedselbereiding: Koken is in feite een reeks van chemische reacties, waarvan vele endotherm of exotherm zijn.
Stel je voor dat je een chemisch ingenieur bent die een nieuwe brandstofcel ontwerpt. Door de enthalpieveranderingen van de reacties te begrijpen, kun je de efficiëntie van de brandstofcel maximaliseren en de hoeveelheid vrijgekomen warmte beheersen. Of, als je een kok bent, helpt het begrijpen van de endotherme reacties die betrokken zijn bij het bakken van een cake je om de perfecte textuur en smaak te bereiken.
Conclusie
Het herkennen van endotherme en exotherme reacties is een fundamentele vaardigheid in de scheikunde en daarbuiten. Door te letten op temperatuurveranderingen, enthalpieveranderingen, en de energie input of output, kun je veel alledaagse fenomenen beter begrijpen. Het is meer dan alleen een theoretisch concept; het is een sleutel tot het begrijpen van de wereld om je heen.
Dus, de volgende keer dat je een ijspak gebruikt of een vuurtje stookt, denk dan even na over de fascinerende scheikunde die erachter schuilgaat. Welke andere alledaagse processen denk je dat endotherm of exotherm zijn? Daag jezelf uit om er een paar te identificeren!
Bekijk ook deze gerelateerde berichten:
- Wanneer Werd De Voc Opgericht
- Hoeveel Botten In Menselijk Lichaam
- Wat Is Een Sociale Kaart
- Hoe Vallen De Schoolvakanties In 2024
- De Verheerlijking Op De Berg
- Hoe Vaak Mag Je Ziek Zijn Op School
- Hoe Schrijf Je Een Nota
- 10 Gram Is Hoeveel Ml
- Wanneer Kan Je Studiefinanciering Aanvragen
- Kinderbijslag En Kindgebonden Budget Verschil
