Hoeveel Bindingen Kan N Aangaan
Heb je je ooit afgevraagd hoe de complexe moleculen die het leven mogelijk maken in elkaar zitten? Een sleutelelement in die puzzel is het vermogen van atomen om verbindingen aan te gaan. In dit artikel duiken we diep in de chemische wereld om te ontdekken hoeveel bindingen stikstof (N), een cruciaal element in DNA, eiwitten en vele andere belangrijke verbindingen, precies kan vormen. We richten ons op studenten, docenten en iedereen met een interesse in scheikunde, die een helder en compleet antwoord willen op deze fundamentele vraag.
Introductie: Stikstof, een Veelzijdig Element
Stikstof is een fascinerend element. Het is een hoofdbestanddeel van de lucht die we inademen (ongeveer 78%), maar het speelt ook een essentiële rol in talloze biologische processen. De manier waarop stikstof verbindingen aangaat, bepaalt de structuur en functie van deze moleculen. Om te begrijpen hoe stikstof werkt, moeten we kijken naar zijn elektronenconfiguratie.
De Elektronenconfiguratie van Stikstof
Stikstof heeft een atoomnummer van 7, wat betekent dat het 7 protonen in zijn kern heeft, en dus ook 7 elektronen in een neutrale toestand. Deze elektronen zijn gerangschikt in verschillende energieniveaus, ook wel schillen genoemd. De eerste schil kan maximaal 2 elektronen bevatten, terwijl de tweede schil maximaal 8 elektronen kan bevatten. De elektronenconfiguratie van stikstof is 1s² 2s² 2p³. Dit betekent dat stikstof 5 elektronen in zijn buitenste schil (de valentie-schil) heeft.
Deze 5 valentie-elektronen zijn cruciaal voor het aangaan van chemische bindingen. Atomen streven naar een stabiele configuratie, meestal met 8 elektronen in hun buitenste schil (de octetregel). Stikstof probeert dus nog 3 elektronen te "vinden" om deze stabiele toestand te bereiken.
Het Aantal Bindingen: Drie is het Antwoord
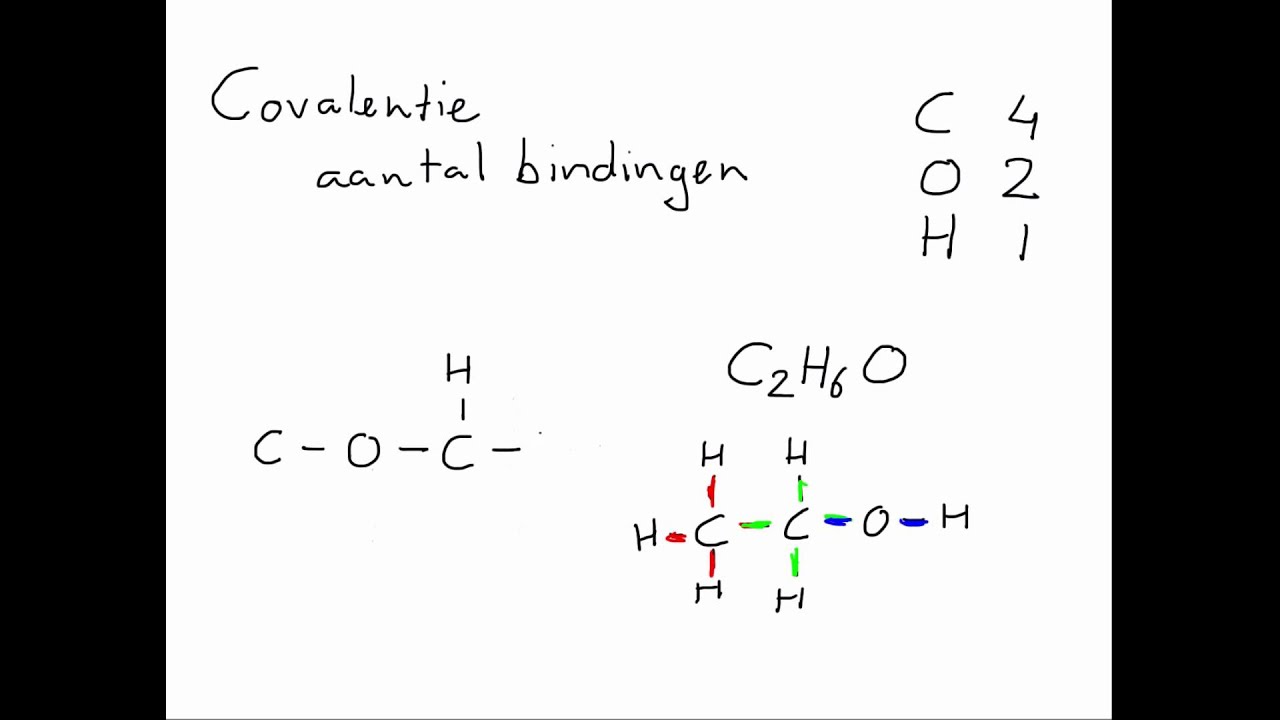
Omdat stikstof 3 elektronen nodig heeft om een octet te voltooien, kan het doorgaans drie covalente bindingen vormen. Dit betekent dat stikstof een elektron kan delen met elk van drie andere atomen, waardoor de stabiliteit toeneemt. Laten we dit illustreren met enkele voorbeelden:
- Ammoniak (NH₃): In ammoniak bindt stikstof met drie waterstofatomen. Elke waterstofatoom deelt één elektron met stikstof, waardoor stikstof zijn octet voltooit (2 elektronen van de s-orbitalen en 6 elektronen van de 3 waterstofatomen).
- Stikstofgas (N₂): Stikstofgas bestaat uit twee stikstofatomen die drievoudig aan elkaar gebonden zijn. Elke stikstofatoom deelt drie elektronen met de andere, waardoor beide atomen hun octet bereiken.
- Amines (R-NH₂): Amines zijn organische verbindingen waarbij stikstof gebonden is aan één of twee koolstofatomen (R-groepen) en de overige bindingen met waterstof.
Uitzonderingen en Variaties
Hoewel stikstof doorgaans drie bindingen aangaat, zijn er uitzonderingen. Stikstof kan ook een vierde binding aangaan, maar dit gebeurt meestal in de vorm van een datieve binding of een gecoördineerde covalente binding. Hierbij deelt stikstof een van zijn vrije elektronenparen met een ander atoom, vaak een metaalion. Een voorbeeld hiervan is het ammonium-ion (NH₄⁺).
In het ammonium-ion heeft stikstof al drie bindingen met waterstofatomen. Het vierde waterstofatoom bindt aan stikstof door het vrije elektronenpaar van stikstof te accepteren. Deze binding is anders dan een normale covalente binding, omdat beide elektronen van één van de atomen (stikstof) komen.
Het is ook belangrijk op te merken dat de aard van de bindingen (enkelvoudig, dubbelvoudig of drievoudig) de eigenschappen van de resulterende moleculen beïnvloedt. Een drievoudige binding, zoals in stikstofgas, is bijvoorbeeld veel sterker en korter dan een enkelvoudige binding.
De Rol van Stikstof in Biologische Systemen
Stikstof is onmisbaar voor het leven. Het is een belangrijk bestanddeel van:
- Eiwitten: Eiwitten zijn opgebouwd uit aminozuren, die allemaal een stikstofatoom bevatten (in de aminogroep -NH₂). De stikstofatomen in aminozuren vormen peptidebindingen die aminozuren aan elkaar koppelen tot lange polypeptideketens, die de basis vormen voor eiwitten.
- Nucleïnezuren (DNA en RNA): DNA en RNA, de dragers van genetische informatie, bevatten stikstofhoudende basen (adenine, guanine, cytosine, thymine en uracil). Deze basen vormen de "treden" van de DNA-ladder en zijn cruciaal voor de opslag en overdracht van genetische informatie.
- Vitamines en Co-enzymen: Veel vitamines en co-enzymen, die essentieel zijn voor verschillende metabolische processen, bevatten stikstofatomen in hun structuur.
Zonder de unieke eigenschappen van stikstof, waaronder het vermogen om drie bindingen aan te gaan, zouden deze essentiële biomoleculen niet kunnen bestaan. Dit benadrukt de cruciale rol van stikstof in de chemie van het leven.
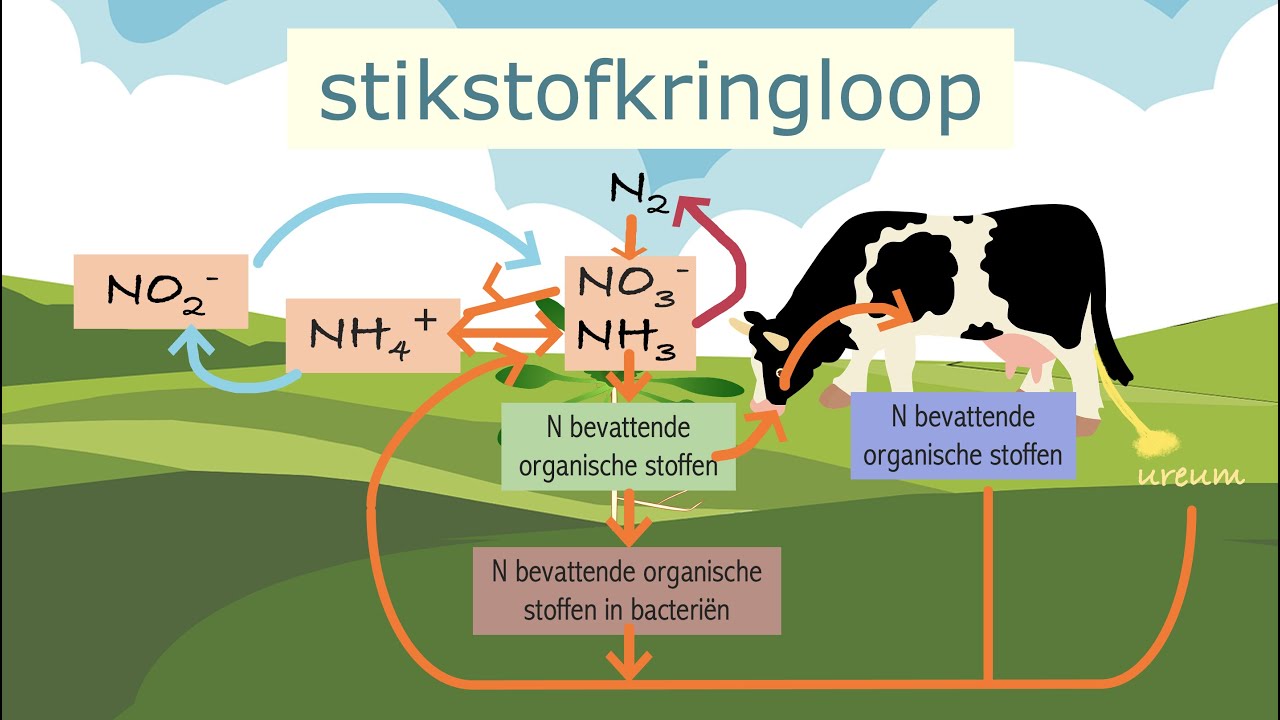
Stikstoffixatie: Een Essentieel Proces
Hoewel stikstof overvloedig aanwezig is in de atmosfeer, is het in die vorm (N₂) niet direct bruikbaar voor de meeste organismen. Stikstoffixatie is het proces waarbij atmosferische stikstof wordt omgezet in bruikbare vormen, zoals ammoniak (NH₃) of nitraat (NO₃⁻). Dit proces wordt voornamelijk uitgevoerd door bepaalde bacteriën, die essentieel zijn voor de stikstofkringloop en de beschikbaarheid van stikstof in ecosystemen.
Deze gefixeerde stikstof wordt vervolgens door planten opgenomen en gebruikt voor de synthese van eiwitten en andere biomoleculen. Dieren verkrijgen stikstof door het consumeren van planten of andere dieren.
Toepassingen van Stikstof in de Industrie
Naast zijn biologische betekenis heeft stikstof ook tal van industriële toepassingen. Hier zijn enkele voorbeelden:
- Meststoffen: Een groot deel van de industriële stikstofproductie wordt gebruikt voor de productie van stikstofhoudende meststoffen. Deze meststoffen zijn essentieel voor het verhogen van de gewasopbrengsten in de landbouw.
- Explosieven: Veel explosieven, zoals dynamiet en TNT, bevatten stikstofhoudende verbindingen. De snelle ontleding van deze verbindingen leidt tot een grote hoeveelheid energie, wat de basis vormt voor hun explosieve eigenschappen.
- Koelmiddel: Vloeibare stikstof wordt gebruikt als koelmiddel vanwege zijn extreem lage temperatuur. Het wordt gebruikt in cryogene toepassingen, zoals het invriezen van biologische monsters en het koelen van elektronische apparatuur.
- Inerte atmosfeer: Stikstofgas wordt gebruikt om een inerte atmosfeer te creëren in verschillende industriële processen, zoals het verpakken van voedsel en het produceren van elektronica. Dit voorkomt oxidatie en andere ongewenste reacties.
De veelzijdigheid van stikstof, dankzij zijn unieke bindingsvermogen, maakt het een onmisbaar element in zowel de natuur als de industrie.
Conclusie: Een Essentiële Bouwsteen
Kortom, stikstof kan doorgaans drie covalente bindingen aangaan. Dit vermogen is cruciaal voor de vorming van een breed scala aan moleculen, van de lucht die we inademen tot de eiwitten en nucleïnezuren die de basis vormen van het leven. Hoewel uitzonderingen mogelijk zijn, zoals datieve bindingen, blijft de regel van drie bindingen een fundamenteel concept in de chemie. Door dit te begrijpen, krijg je een dieper inzicht in de complexe wereld van moleculen en de rol die stikstof speelt in onze wereld. We hopen dat dit artikel je een helder en begrijpelijk antwoord heeft gegeven op de vraag: Hoeveel bindingen kan N aangaan? Blijf leren en ontdekken!
Bekijk ook deze gerelateerde berichten:
- Wat Is Het Prader Willi Syndroom
- Wat Is Een Collectieve Arbeidsovereenkomst
- Wat Is De Eenheid Van Volume
- Wat Is Een Balanced Scorecard
- Hoe Word Je Eindexamen Cijfer Berekend
- Aantal Joden Vermoord Tweede Wereldoorlog In Nederland
- Voorjaarsvakantie 2024 Wat Te Doen
- Wat Is Creatine In Het Bloed
- Teller En Noemer In Een Breuk
- Hoe Moet Je Een Sollicitatiebrief Schrijven
