Wanneer Is Een Stof Polair
Heb je je ooit afgevraagd waarom water en olie niet mengen? Of waarom sommige stoffen gemakkelijk oplossen in water, terwijl andere dat absoluut niet doen? Het antwoord ligt vaak in een fundamenteel concept in de scheikunde: polariteit. Dit artikel is geschreven voor iedereen die geïnteresseerd is in scheikunde, van studenten tot nieuwsgierige geesten die meer willen weten over de wereld om hen heen. We gaan dieper in op wat polariteit precies is, hoe je kunt bepalen of een stof polair is, en waarom het zo belangrijk is in allerlei chemische processen.
Wat is Polariteit Eigenlijk?
In de kern verwijst polariteit naar een ongelijke verdeling van elektrische lading binnen een molecuul. Stel je een touw voor dat wordt getrokken door twee mensen. Als beide mensen even sterk zijn, blijft het touw in het midden. Maar als één persoon sterker is, zal het touw naar die persoon toe bewegen. In een molecuul zijn de "mensen" atomen en het "touw" zijn de elektronen die ze delen in een chemische binding. Als een atoom sterker aan de elektronen trekt dan het andere, ontstaat er een polaire binding. Dit betekent dat één uiteinde van de binding een lichte negatieve lading (δ-) krijgt, terwijl het andere uiteinde een lichte positieve lading (δ+) krijgt.
Elektronegativiteit: De "Treksterkte" van Atomen
De "treksterkte" van een atoom wordt bepaald door zijn elektronegativiteit. Elektronegativiteit is een maat voor het vermogen van een atoom om elektronen naar zich toe te trekken in een chemische binding. Hoe hoger de elektronegativiteit, hoe sterker de "trek" van het atoom. Linus Pauling, een beroemde scheikundige, ontwikkelde een schaal om de elektronegativiteit van verschillende elementen te kwantificeren. Enkele belangrijke punten:
- Fluor (F) is het meest elektronegatieve element.
- Zuurstof (O) en Stikstof (N) zijn ook zeer elektronegatief.
- Koolstof (C) en Waterstof (H) hebben relatief vergelijkbare elektronegativiteiten.
Het verschil in elektronegativiteit tussen twee atomen in een binding is cruciaal. Als het verschil groot genoeg is (over het algemeen groter dan 0,4 op de Pauling-schaal), beschouwen we de binding als polaire covalent. Een groot verschil duidt op een sterke trek, wat leidt tot een significante ladingsverdeling.
Hoe Bepaal Je of een Stof Polair Is?
Het bepalen van de polariteit van een stof is een proces in twee stappen:
- Identificeer de polaire bindingen: Zoek naar bindingen tussen atomen met een significant verschil in elektronegativiteit. Denk aan O-H, N-H, C=O, en F-H bindingen.
- Bekijk de moleculaire geometrie: Zelfs als een molecuul polaire bindingen bevat, kan het *hele* molecuul toch niet-polair zijn. Dit hangt af van de vorm van het molecuul.
Moleculaire Geometrie en Dipoolmomenten
De moleculaire geometrie, of de 3D-arrangement van atomen in een molecuul, is cruciaal. Polaire bindingen hebben een dipoolmoment, dat een vector is die de grootte en richting van de ladingsscheiding weergeeft. Stel je voor dat elk polair binding een kleine pijl is die wijst van het positieve naar het negatieve uiteinde. Als deze pijlen elkaar opheffen (bijvoorbeeld in een symmetrisch molecuul), dan is het *hele* molecuul niet-polair.
Hier zijn enkele voorbeelden om dit te illustreren:
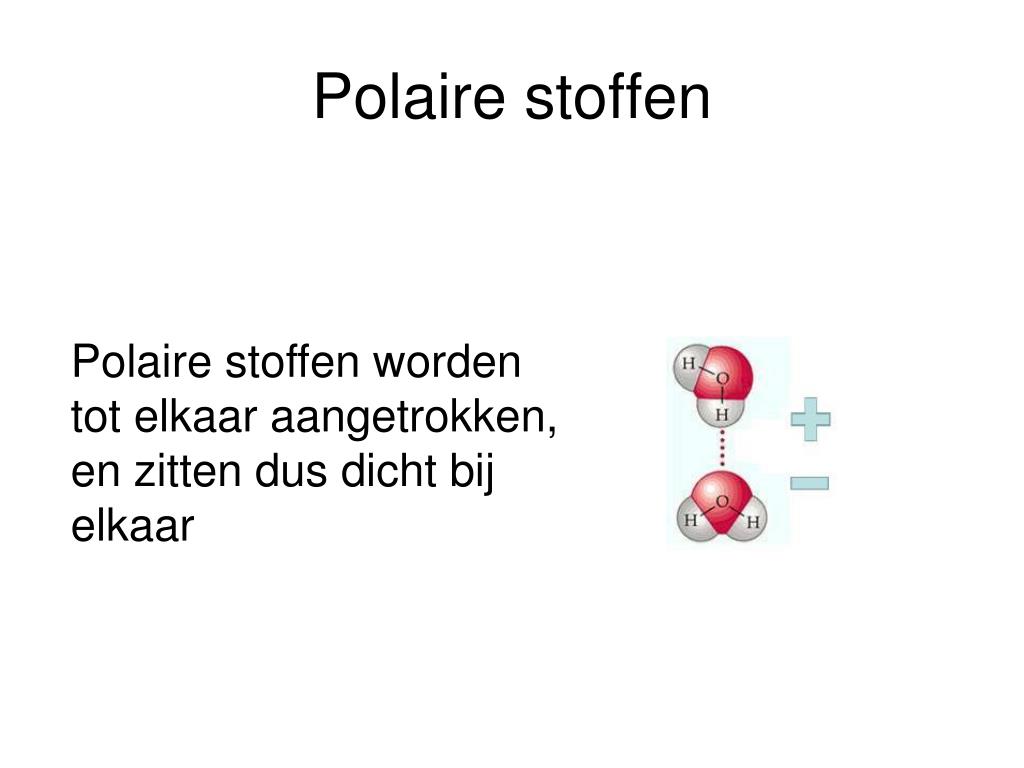
- Water (H2O): Water heeft twee O-H bindingen, die zeer polair zijn. De moleculaire geometrie is gebogen (bent). De dipoolmomenten van de twee O-H bindingen heffen elkaar niet op, waardoor water een polair molecuul is. Dit is cruciaal voor het leven zoals we het kennen!
- Koolstofdioxide (CO2): Koolstofdioxide heeft twee C=O bindingen, die ook polair zijn. De moleculaire geometrie is lineair. De dipoolmomenten van de twee C=O bindingen wijzen in tegengestelde richtingen en heffen elkaar *wel* op. Daardoor is CO2 een niet-polair molecuul.
- Ammoniak (NH3): Ammoniak heeft drie N-H bindingen. De moleculaire geometrie is trigonaal piramidaal. De dipoolmomenten van de N-H bindingen heffen elkaar niet op, waardoor ammoniak een polair molecuul is.
- Methaan (CH4): Methaan heeft vier C-H bindingen. Hoewel er een klein verschil in elektronegativiteit is, is de moleculaire geometrie tetraëdrisch. De dipoolmomenten van de C-H bindingen heffen elkaar op, waardoor methaan een niet-polair molecuul is.
Een Stappenplan voor Polariteit Bepalen
Laten we het samenvatten in een handig stappenplan:
- Teken de Lewisstructuur: Dit helpt je om de bindingen in het molecuul te zien.
- Bepaal de moleculaire geometrie: Gebruik VSEPR-theorie (Valence Shell Electron Pair Repulsion) om de vorm van het molecuul te voorspellen.
- Identificeer polaire bindingen: Kijk naar de verschillen in elektronegativiteit.
- Teken dipoolmomenten: Teken pijlen die de richting van de ladingsscheiding weergeven.
- Analyseer de dipoolmomenten: Hefte de dipoolmomenten elkaar op? Als dat zo is, is het molecuul niet-polair. Zo niet, dan is het molecuul polair.
Waarom is Polariteit Belangrijk?
Polariteit heeft een enorme impact op de eigenschappen van stoffen en hun interacties met andere stoffen. Hier zijn een paar belangrijke voorbeelden:
- Oplosbaarheid: De regel "gelijk lost gelijk op" is gebaseerd op polariteit. Polaire stoffen lossen goed op in polaire oplosmiddelen (zoals water), terwijl niet-polaire stoffen goed oplossen in niet-polaire oplosmiddelen (zoals olie). Dit verklaart waarom water en olie niet mengen. Water, een polaire stof, heeft een sterke aantrekkingskracht op andere polaire moleculen, maar niet op de niet-polaire moleculen in olie.
- Kookpunten: Polaire moleculen hebben over het algemeen hogere kookpunten dan niet-polaire moleculen met vergelijkbare molecuulmassa's. Dit komt doordat de dipool-dipoolinteracties (aantrekkingen tussen polaire moleculen) sterker zijn dan de Van der Waals-krachten (aantrekkingen tussen niet-polaire moleculen). Meer energie is nodig om deze sterkere intermoleculaire krachten te overwinnen om de stof te laten koken.
- Biologische processen: Polariteit is cruciaal in biologische systemen. Water, als polair oplosmiddel, is essentieel voor veel biochemische reacties. De structuur en functie van eiwitten en DNA worden ook sterk beïnvloed door polariteit. Denk bijvoorbeeld aan de hydrofobe (waterafstotende) en hydrofiele (wateraantrekkende) gebieden van eiwitten, die de vorm en de interacties van het eiwit bepalen.
- Reinigingsmiddelen: Zeep en detergenten werken door een combinatie van polaire en niet-polaire eigenschappen. Ze hebben een polaire "kop" die zich aan water hecht en een niet-polaire "staart" die zich aan vet en vuil hecht. Hierdoor kunnen ze vet en vuil in water emulgeren en wegspoelen.
Polariteit in de Praktijk: Voorbeelden uit het Dagelijks Leven
Denk eens aan je eigen ervaringen. Waarom lost suiker (een polaire stof) gemakkelijk op in koffie (voornamelijk water, een polaire stof)? Maar waarom krijg je een vette vlek van je kleding nauwelijks weg met alleen water? Omdat vet niet-polair is en water polair, zijn ze niet compatibel. Je hebt zeep (met zowel polaire als niet-polaire delen) nodig om de verbinding te maken en het vet weg te wassen. Of denk aan kookgerei met een anti-aanbaklaag. Deze coating is meestal gemaakt van teflon, een niet-polaire stof die voorkomt dat voedsel eraan blijft plakken, omdat de meeste voedingsmiddelen een zekere mate van polariteit bezitten.
Conclusie: Een Dieper Begrip van de Wereld Om Ons Heen
Polariteit is een fundamenteel concept in de scheikunde met verstrekkende gevolgen. Door te begrijpen hoe polariteit werkt, kunnen we de eigenschappen van stoffen en hun interacties met elkaar beter begrijpen. Het stelt ons in staat om te voorspellen hoe stoffen zich zullen gedragen en om nieuwe materialen en technologieën te ontwikkelen. Of je nu een student bent, een wetenschapper, of gewoon iemand die nieuwsgierig is naar de wereld, het begrip van polariteit zal je een dieper inzicht geven in de essentiële chemie die het leven mogelijk maakt en de materialen vormt die we dagelijks gebruiken. Blijf onderzoeken, blijf leren en blijf je verwonderen over de complexiteit en schoonheid van de chemie!


Bekijk ook deze gerelateerde berichten:
- Cv Voorbeeld In Het Engels
- Wat Is De 5.5 Regel
- Wanneer Is De Carnavalsvakantie 2024
- Wat Is Een Zeldzame Bloedgroep
- Hoe Vermeld Je Een Bron In De Tekst
- Hoe Ziet Een Volleybal Eruit
- Examen Havo 2023 Wiskunde A
- Hoeveel Ayat Heeft De Koran
- Wat Is Verschil Tussen Mri En Ct Scan
- Hoeveel Soorten Tomaten Zijn Er
