Wat Is De Molaire Massa
De molaire massa, ook wel molecuulgewicht genoemd, is een fundamenteel concept in de scheikunde dat cruciaal is voor het begrijpen van de samenstelling en hoeveelheid van stoffen. Het verbindt de macroscopische wereld die we kunnen waarnemen en meten met de microscopische wereld van atomen en moleculen. Een goed begrip van de molaire massa is essentieel voor het uitvoeren van chemische berekeningen, het interpreteren van experimentele resultaten en het ontwikkelen van nieuwe materialen.
Wat is de Molaire Massa precies?
De molaire massa is de massa van één mol van een stof. Een mol is gedefinieerd als 6,022 x 1023 (het getal van Avogadro) deeltjes, dit kunnen atomen, moleculen, ionen of andere gespecificeerde entiteiten zijn. De molaire massa wordt meestal uitgedrukt in gram per mol (g/mol). Het is belangrijk om te benadrukken dat de molaire massa een specifieke eigenschap is voor elke chemische stof. Zo heeft water (H2O) een andere molaire massa dan bijvoorbeeld natriumchloride (NaCl), oftewel keukenzout.
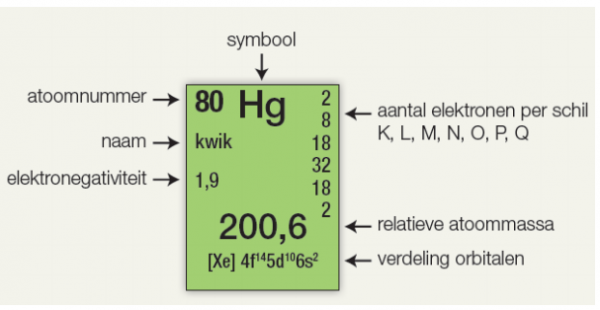
De molaire massa is numeriek gelijk aan de atoommassa of molecuulmassa van een stof, uitgedrukt in atomaire massa-eenheden (amu). De atoommassa van een element staat vermeld in het periodiek systeem. Om de molecuulmassa te berekenen, tel je de atoommassa's van alle atomen in het molecuul bij elkaar op.
Het Belang van de Atoommassa
De atoommassa is de massa van een atoom, meestal uitgedrukt in atomaire massa-eenheden (amu). Een amu is gedefinieerd als 1/12 van de massa van een koolstof-12 atoom. Het periodiek systeem der elementen is een cruciale bron voor het vinden van de atoommassa van elk element. Het is belangrijk op te merken dat de waarden in het periodiek systeem de gewogen gemiddelde atoommassa's vertegenwoordigen, rekening houdend met de natuurlijke abundantie van de verschillende isotopen van een element. Bijvoorbeeld, chloor (Cl) heeft twee belangrijke isotopen: chloor-35 en chloor-37. De atoommassa van chloor, zoals vermeld in het periodiek systeem, is ongeveer 35,45 amu, wat een gewogen gemiddelde is van de massa's van deze twee isotopen.
Hoe Bereken je de Molaire Massa?
Het berekenen van de molaire massa is een vrij eenvoudig proces, maar het vereist nauwkeurigheid en aandacht voor detail. Hier zijn de stappen:
- Identificeer de chemische formule: Bepaal de exacte chemische formule van de stof waarvoor je de molaire massa wilt berekenen. Bijvoorbeeld, de chemische formule van glucose is C6H12O6.
- Zoek de atoommassa's op: Raadpleeg een periodiek systeem om de atoommassa's van elk element in de formule te vinden. Bijvoorbeeld, de atoommassa van koolstof (C) is ongeveer 12,01 amu, waterstof (H) is ongeveer 1,01 amu, en zuurstof (O) is ongeveer 16,00 amu.
- Vermenigvuldig en tel op: Vermenigvuldig de atoommassa van elk element met het aantal keren dat dat element in de formule voorkomt. Tel vervolgens al deze waarden bij elkaar op. Voor glucose (C6H12O6) is de berekening als volgt:
- (6 x 12,01 amu) + (12 x 1,01 amu) + (6 x 16,00 amu) = 72,06 amu + 12,12 amu + 96,00 amu = 180,18 amu
- Druk uit in g/mol: Vervang de amu (atomaire massa-eenheden) door g/mol (gram per mol). Dus de molaire massa van glucose is 180,18 g/mol.
Voorbeelden van Berekeningen
Laten we enkele voorbeelden bekijken om het proces te illustreren:
- Water (H2O): (2 x 1,01 g/mol) + (1 x 16,00 g/mol) = 18,02 g/mol
- Natriumchloride (NaCl): (1 x 22,99 g/mol) + (1 x 35,45 g/mol) = 58,44 g/mol
- Zwavelzuur (H2SO4): (2 x 1,01 g/mol) + (1 x 32,07 g/mol) + (4 x 16,00 g/mol) = 98,09 g/mol
Toepassingen van de Molaire Massa
De molaire massa is essentieel voor een breed scala aan toepassingen in de scheikunde en aanverwante vakgebieden:
Stoichiometrie
Stoichiometrie is de studie van de kwantitatieve relaties tussen reactanten en producten in chemische reacties. De molaire massa stelt ons in staat om massa om te zetten in molen en vice versa, wat cruciaal is voor het berekenen van de hoeveelheden reactanten en producten die betrokken zijn bij een reactie. Bijvoorbeeld, als we weten dat een reactie 10 gram waterstofgas (H2) nodig heeft, kunnen we met behulp van de molaire massa van waterstof (2,02 g/mol) berekenen hoeveel mol waterstof we nodig hebben. Dit is fundamenteel voor het plannen van experimenten en het optimaliseren van chemische processen.
Oplossingen en Concentraties
De molaire massa is ook cruciaal voor het bereiden van oplossingen met bekende concentraties. De molariteit (M) van een oplossing is gedefinieerd als het aantal mol opgeloste stof per liter oplossing. Om een oplossing met een bepaalde molariteit te bereiden, moeten we weten hoeveel gram opgeloste stof we moeten oplossen in een bepaald volume oplosmiddel. De molaire massa van de opgeloste stof is essentieel voor deze berekening.
Stel dat we een 0,1 M oplossing van natriumchloride (NaCl) in water willen bereiden. We weten dat de molaire massa van NaCl 58,44 g/mol is. Om 1 liter van een 0,1 M oplossing te bereiden, moeten we 0,1 mol NaCl afwegen. Met behulp van de molaire massa kunnen we berekenen dat 0,1 mol NaCl gelijk is aan 0,1 mol x 58,44 g/mol = 5,844 gram. Dus, om de oplossing te bereiden, lossen we 5,844 gram NaCl op in voldoende water om een totaal volume van 1 liter te verkrijgen.
Analyse van Onbekende Stoffen
In de analytische chemie wordt de molaire massa vaak gebruikt om onbekende stoffen te identificeren. Door middel van verschillende experimentele technieken, zoals massaspectrometrie, kan de molaire massa van een onbekende stof worden bepaald. Deze informatie kan vervolgens worden gebruikt om de chemische formule van de stof te bepalen en de stof te identificeren.
Real-world Voorbeelden en Data
De molaire massa wordt in talloze industrieën en onderzoeksgebieden gebruikt. In de farmaceutische industrie is het van cruciaal belang voor het berekenen van de doseringen van medicijnen. De correcte dosering is essentieel voor de effectiviteit en veiligheid van een medicijn. In de voedingsmiddelenindustrie wordt de molaire massa gebruikt voor het analyseren van de samenstelling van voedingsmiddelen en het bepalen van de voedingswaarde.
Een ander voorbeeld is het bepalen van de molecuulformule van een onbekende organische verbinding. Door elementaire analyse (het bepalen van de massapercentages van de verschillende elementen in de verbinding) te combineren met een nauwkeurige bepaling van de molaire massa (bijvoorbeeld met behulp van massaspectrometrie), kan men de empirische formule en vervolgens de molecuulformule van de verbinding vaststellen.
Hieronder een tabel met enkele voorbeelden van stoffen en hun molaire massa's:
| Stof | Chemische Formule | Molaire Massa (g/mol) |
|---|---|---|
| Water | H2O | 18.02 |
| Koolstofdioxide | CO2 | 44.01 |
| Glucose | C6H12O6 | 180.16 |
| Ethanol | C2H5OH | 46.07 |
| Ammoniak | NH3 | 17.03 |
Conclusie
De molaire massa is een fundamenteel concept in de scheikunde met brede toepassingen. Van het berekenen van de hoeveelheden reactanten en producten in chemische reacties tot het bereiden van oplossingen met bekende concentraties, de molaire massa is een essentieel hulpmiddel voor scheikundigen en andere wetenschappers. Een goed begrip van de molaire massa is cruciaal voor succes in de scheikunde. Het is belangrijk om de basisprincipes van het berekenen van de molaire massa te beheersen en de praktische toepassingen ervan te begrijpen.
Neem de tijd om te oefenen met het berekenen van de molaire massa van verschillende stoffen. Gebruik een periodiek systeem als hulpmiddel en probeer complexere moleculen aan te pakken. Door te oefenen, zul je je vaardigheden verbeteren en een dieper begrip van dit belangrijke concept ontwikkelen. Blijf leren en onderzoek de vele manieren waarop de molaire massa wordt gebruikt in de scheikunde en aanverwante vakgebieden. Begrijp dat precisie in de chemie cruciaal is. Leer nauwkeurig werken en correcte berekeningen te maken. De molaire massa is slechts een van de vele bouwstenen die je nodig hebt om een succesvolle scheikundige te worden!
![Molare Masse berechnen • Formel & Erklärung · [mit Video] - Wat Is De Molaire Massa](https://www.kerkberichten.info/storage/bing/molare-masse-berechnen-formel-erklarung-mit-video-6850a516be785.jpg)

Bekijk ook deze gerelateerde berichten:
- Hoe Is De Erfelijke Informatie In Het Dna Opgeslagen
- Wat Is De Functie Van De Slokdarm
- Waar Ligt De Middellandse Zee
- Bombing On Hiroshima And Nagasaki
- Valuta Van Dollar Naar Euro
- Met Moedermelk Voeden 5 Letters
- Hoe Laat Moet Een Kind Van 12 Naar Bed
- Ik En Mijn Huis Wij Zullen De Heere Dienen
- Wat Is De Functie Van Koolhydraten
- Hoeveel Uur Mag Je Werken Als Je 15 Bent
