Wat Is Een Mol Stof
Heb je je ooit afgevraagd hoe chemici in staat zijn om de juiste hoeveelheid van een stof te gebruiken in een reactie? Of hoe ze nauwkeurig de hoeveelheid product kunnen berekenen die zal ontstaan? Het antwoord ligt in een fundamenteel concept: de mol.
Misschien klinkt het ingewikkeld, en toegegeven, de mol kan in eerste instantie intimiderend lijken. Maar in werkelijkheid is het een essentieel hulpmiddel dat de wereld van de chemie begrijpelijker en beheersbaarder maakt. Deze uitleg is er voor jou, want je bent waarschijnlijk in de war over dit onderwerp.
Wat is een Mol?
De mol is de SI-eenheid (Système International d'Unités) voor de hoeveelheid stof. Stel je voor: in plaats van individuele atomen of moleculen te tellen – wat praktisch onmogelijk is – groeperen we ze in handige 'pakketten' die we mollen noemen.
Denk aan een dozijn eieren. Een dozijn is altijd 12, ongeacht of het om eieren, koekjes of knikkers gaat. Op dezelfde manier is een mol altijd een bepaald aantal deeltjes: 6,022 x 1023. Dit getal staat bekend als de constante van Avogadro, genoemd naar de Italiaanse wetenschapper Amedeo Avogadro.
Dus, één mol is 6,022 x 1023 deeltjes. Deze deeltjes kunnen atomen, moleculen, ionen of andere elementaire entiteiten zijn. Het is een gigantisch aantal, maar het is noodzakelijk omdat atomen en moleculen ongelooflijk klein zijn.
Waarom is de Mol Belangrijk?
De mol biedt een praktische manier om microscopische deeltjes te relateren aan macroscopische hoeveelheden die we in het laboratorium kunnen meten en wegen. Stel je voor dat je een recept volgt. Je zou toch ook liever zeggen "voeg 1 theelepel zout toe" in plaats van "voeg 1.000.000.000.000.000.000.000.000 natrium- en chloride-ionen toe"? Dat is precies wat de mol voor chemici doet – het vereenvoudigt de communicatie en het uitvoeren van experimenten.
Hier zijn enkele belangrijke redenen waarom de mol zo cruciaal is:
- Stoichiometrie: De mol is de sleutel tot het begrijpen van de stoichiometrie van chemische reacties, dat wil zeggen, de kwantitatieve relaties tussen reactanten en producten. Het helpt ons te voorspellen hoeveel reactant we nodig hebben om een bepaalde hoeveelheid product te maken.
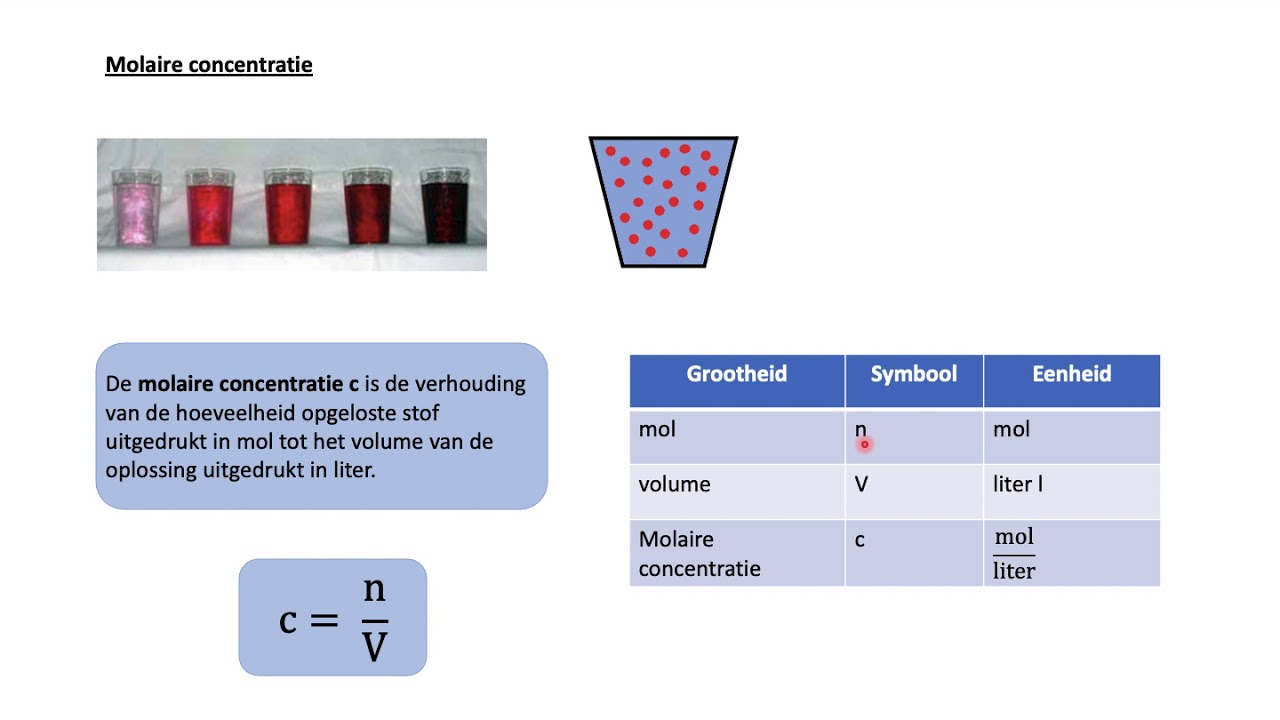
- Oplossingsconcentraties: De mol wordt gebruikt om de concentratie van oplossingen uit te drukken, meestal in molariteit (mol per liter). Dit is essentieel bij het bereiden van oplossingen met de juiste concentratie voor experimenten.
- Gaswetten: De mol speelt een cruciale rol in de gaswetten, zoals de ideale gaswet (PV = nRT), die de relatie tussen druk, volume, temperatuur en de hoeveelheid gas (in mol) beschrijft.
- Analyse: In de analytische chemie wordt de mol gebruikt om de hoeveelheid van een bepaalde stof in een monster te bepalen.
Molmassa: De Link tussen Mollen en Massa
De molmassa is de massa van één mol van een stof, uitgedrukt in gram per mol (g/mol). Het is de cruciale link tussen het aantal mol en de massa die we in het laboratorium kunnen meten.
De molmassa van een element is numeriek gelijk aan de atoommassa van dat element, te vinden in het periodiek systeem. Bijvoorbeeld, de atoommassa van koolstof (C) is ongeveer 12,01, dus de molmassa van koolstof is 12,01 g/mol. Dit betekent dat 1 mol koolstofatomen een massa heeft van 12,01 gram.
Voor een verbinding bereken je de molmassa door de atoommassa's van alle atomen in de formule van de verbinding op te tellen. Bijvoorbeeld, de molmassa van water (H2O) is:
(2 x atoommassa van H) + (1 x atoommassa van O) = (2 x 1,01 g/mol) + (1 x 16,00 g/mol) = 18,02 g/mol
Dit betekent dat 1 mol watermoleculen een massa heeft van 18,02 gram.
Hoe de Molmassa te Gebruiken
Met de molmassa kunnen we eenvoudig omrekenen tussen massa en aantal mol:
- Omrekenen van massa naar mol: Deel de massa (in gram) door de molmassa (in g/mol).
- Omrekenen van mol naar massa: Vermenigvuldig het aantal mol met de molmassa (in g/mol).
Bijvoorbeeld:
Vraag: Hoeveel mol is 50 gram natriumchloride (NaCl)?
Antwoord: De molmassa van NaCl is 58,44 g/mol. Dus, 50 g NaCl / 58,44 g/mol = 0,856 mol NaCl.
Vraag: Wat is de massa van 0,25 mol glucose (C6H12O6)?
Antwoord: De molmassa van glucose is 180,16 g/mol. Dus, 0,25 mol C6H12O6 x 180,16 g/mol = 45,04 g C6H12O6.
Veelvoorkomende Misvattingen over de Mol
Er zijn enkele veelvoorkomende misvattingen over de mol die het belangrijk is om uit de weg te ruimen:
- "De mol is alleen voor chemici": Hoewel de mol voornamelijk in de chemie wordt gebruikt, kan het concept ook relevant zijn in andere wetenschappelijke disciplines, zoals de biologie en de materiaalkunde. Het begrijpen van de mol kan helpen om kwantitatieve aspecten van deze vakgebieden beter te begrijpen.
- "De mol is een abstract concept zonder praktische toepassing": Zoals we hebben gezien, is de mol een fundamenteel hulpmiddel voor het uitvoeren van chemische berekeningen, het bereiden van oplossingen en het begrijpen van chemische reacties. Het heeft talloze praktische toepassingen in de industrie, de geneeskunde en het onderzoek.
- "De mol is te moeilijk om te begrijpen": Hoewel de mol in eerste instantie intimiderend kan lijken, is het in wezen een handige manier om grote aantallen deeltjes te tellen. Met oefening en de juiste uitleg kan iedereen het concept van de mol onder de knie krijgen.
Tegenargumenten en Alternatieve Benaderingen
Sommige mensen beweren dat de nadruk op de mol in de chemie onnodig ingewikkeld is. Ze suggereren dat het werken met verhoudingen en massaprocenten directer en intuïtiever kan zijn. Hoewel deze benaderingen in sommige gevallen nuttig kunnen zijn, bieden ze niet dezelfde systematische en algemene aanpak als de mol. De mol maakt het mogelijk om complexe stoichiometrische berekeningen uit te voeren en de relaties tussen verschillende stoffen in een reactie nauwkeurig te voorspellen. Bovendien is de mol de standaardeenheid voor de hoeveelheid stof in het SI-systeem, waardoor het essentieel is voor de communicatie en de consistentie in de wetenschappelijke gemeenschap.
Een andere kritiek is dat de constante van Avogadro (6,022 x 1023) een nogal arbitrair getal is. Waarom specifiek dit getal kiezen? Het antwoord is dat dit getal is gekozen om de molmassa van een stof numeriek gelijk te maken aan de atoommassa of molecuulmassa, uitgedrukt in atomaire massa-eenheden (amu). Hierdoor kunnen we de massa van individuele atomen en moleculen eenvoudig relateren aan de massa van meetbare hoeveelheden stof in het laboratorium.
Oefening Baart Kunst
Het begrijpen van de mol vereist oefening. Begin met eenvoudige problemen en werk geleidelijk naar complexere scenario's toe. Hier zijn enkele oefensuggesties:
- Bereken de molmassa van verschillende stoffen: Gebruik het periodiek systeem om de atoommassa's van de elementen te vinden en bereken de molmassa van verschillende verbindingen.
- Converteer tussen massa en mol: Oefen het omrekenen van een gegeven massa van een stof naar het aantal mol en omgekeerd.
- Los stoichiometrische problemen op: Gebruik de mol om de hoeveelheden reactanten en producten in een chemische reactie te berekenen.
- Bereid oplossingen met een bepaalde molariteit: Oefen het berekenen van de massa van een stof die nodig is om een oplossing met een bepaalde molariteit te bereiden.
Er zijn tal van online bronnen en leerboeken die oefenproblemen en oplossingen bieden. Aarzel niet om hulp te vragen aan je docent of medestudenten als je vastloopt.
De Mol in het Dagelijks Leven?
Hoewel je misschien niet direct in je dagelijks leven met mollen rekent, zijn de principes achter de mol overal aanwezig. Denk aan:
- Medicatie: De dosering van medicijnen is gebaseerd op de hoeveelheid werkzame stof, vaak uitgedrukt in millimol (mmol).
- Voeding: De hoeveelheid voedingsstoffen in voedingsmiddelen, zoals vitaminen en mineralen, kan worden uitgedrukt in milligram (mg), wat kan worden omgezet in millimol met behulp van de molmassa.
- Milieu: De concentratie van verontreinigende stoffen in de lucht of het water kan worden uitgedrukt in microgram per liter (µg/L), wat kan worden omgezet in micromol per liter (µmol/L) om de impact op het milieu te beoordelen.
De chemie, en daarmee de mol, vormt de basis voor talloze processen en producten die ons dagelijks leven beïnvloeden.
Conclusie
De mol is een krachtig hulpmiddel dat de wereld van de chemie toegankelijker en begrijpelijker maakt. Het is de sleutel tot het begrijpen van de kwantitatieve relaties tussen stoffen en het uitvoeren van nauwkeurige chemische berekeningen. Hoewel het concept in eerste instantie misschien ingewikkeld lijkt, is het met oefening en de juiste uitleg zeker te beheersen. Hopelijk heb je nu een beter begrip van wat een mol is, waarom het belangrijk is en hoe je het in de praktijk kunt gebruiken.
Dus, ben je nu klaar om de uitdaging aan te gaan en zelf met de mol aan de slag te gaan?


Bekijk ook deze gerelateerde berichten:
- Hoe Lang Duurt Mbo 4
- Hoe Bereken Je De Oude Prijs Na Korting
- Gebed Tot De Heilige Geest
- Hij Geeft Het Zijn Beminden In De Slaap
- Hoe Bereken Ik Mijn Nettoloon
- Dagen Van De Week In Engels
- Leer Mij O Heer Uw Lijden Recht Betrachten Tekst
- Wat Is Een Impuls Biologie
- Percentage Verschil Tussen 2 Getallen
- Welk Volk Vestigde Zich Rond 500 Voor Chr In Bretagne
