Hoe Weet Je Hoeveel Neutronen Een Atoom Heeft
Het bepalen van het aantal neutronen in een atoom is een fundamenteel aspect van de chemie en natuurkunde. Neutronen, samen met protonen, vormen de kern van een atoom, en hun aantal heeft een directe invloed op de stabiliteit en de eigenschappen van een element. In dit artikel leggen we uit hoe je kunt achterhalen hoeveel neutronen een specifiek atoom bevat, en duiken we dieper in de achterliggende concepten en berekeningen.
De Basisbeginselen: Atoomnummer en Massagetal
Om te bepalen hoeveel neutronen een atoom heeft, moeten we eerst twee cruciale concepten begrijpen: het atoomnummer (Z) en het massagetal (A). Deze twee getallen, samen met de symbolische notatie van een element, geven ons de benodigde informatie.
Atoomnummer (Z): De Identiteit van een Element
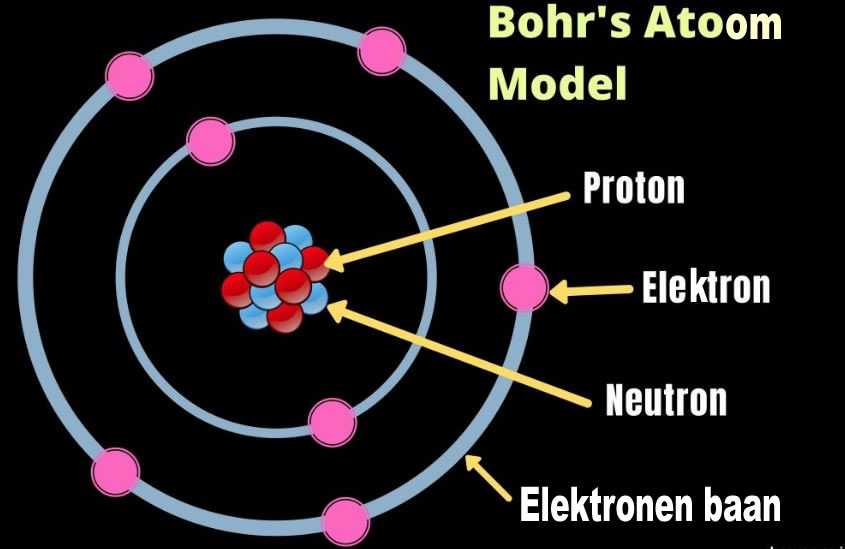
Het atoomnummer, ook wel protonnummer genoemd, is het aantal protonen in de kern van een atoom. Dit getal definieert welk element we voor ons hebben. Zo heeft waterstof (H) een atoomnummer van 1 (één proton), helium (He) een atoomnummer van 2 (twee protonen), en zuurstof (O) een atoomnummer van 8 (acht protonen). Het atoomnummer is uniek voor elk element en staat vermeld in het periodiek systeem.
Belangrijk: Het aantal protonen bepaalt de chemische eigenschappen van een element. Als het aantal protonen verandert, verandert het element.
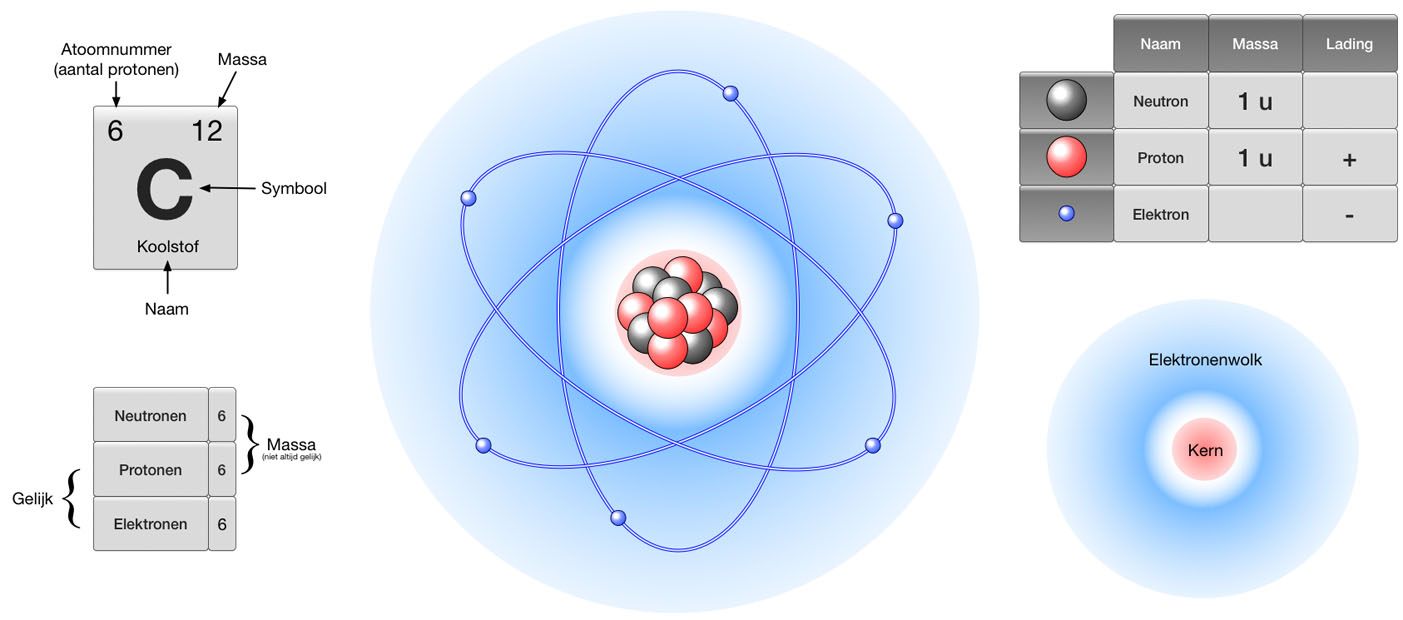
Massagetal (A): De Som van Protonen en Neutronen
Het massagetal is de totale som van het aantal protonen en neutronen in de kern van een atoom. Omdat protonen en neutronen de belangrijkste bijdrage leveren aan de massa van een atoom (de massa van elektronen is verwaarloosbaar in vergelijking), geeft het massagetal een goede indicatie van de atoommassa. Het massagetal wordt meestal weergegeven als een superscript links van het elementsymbool (bijv. 12C of 235U).
Let op: Het massagetal is niet hetzelfde als de atoommassa die in het periodiek systeem staat. De atoommassa is een gewogen gemiddelde van de massa's van alle isotopen van een element, rekening houdend met hun natuurlijke voorkomen.
De Formule: Neutronen Berekenen
Nu we de basisconcepten begrijpen, kunnen we de formule toepassen om het aantal neutronen te berekenen:
Aantal neutronen (N) = Massagetal (A) - Atoomnummer (Z)
Deze formule is eenvoudig maar krachtig. Door het atoomnummer (aantal protonen) af te trekken van het massagetal (aantal protonen + neutronen), krijgen we het aantal neutronen.
Voorbeelden van Berekeningen
Laten we een paar voorbeelden bekijken om de formule te illustreren:
- Koolstof-12 (12C): Koolstof heeft een atoomnummer van 6 (Z = 6). Koolstof-12 heeft een massagetal van 12 (A = 12). Dus het aantal neutronen is N = 12 - 6 = 6. Koolstof-12 heeft dus 6 neutronen.
- Uranium-238 (238U): Uranium heeft een atoomnummer van 92 (Z = 92). Uranium-238 heeft een massagetal van 238 (A = 238). Dus het aantal neutronen is N = 238 - 92 = 146. Uranium-238 heeft dus 146 neutronen.
- Zuurstof-16 (16O): Zuurstof heeft een atoomnummer van 8 (Z = 8). Zuurstof-16 heeft een massagetal van 16 (A = 16). Dus het aantal neutronen is N = 16 - 8 = 8. Zuurstof-16 heeft dus 8 neutronen.
Isotopen: Variaties in het Aantal Neutronen
Een element kan verschillende vormen hebben, die isotopen worden genoemd. Isotopen van een element hebben hetzelfde aantal protonen (hetzelfde atoomnummer), maar een verschillend aantal neutronen. Dit betekent dat isotopen van hetzelfde element verschillende massagetallen hebben.
Voorbeeld: Koolstof heeft verschillende isotopen, waaronder koolstof-12 (12C), koolstof-13 (13C), en koolstof-14 (14C). Alle drie de isotopen hebben 6 protonen (Z = 6), maar ze hebben respectievelijk 6, 7 en 8 neutronen.
Het Belang van Isotopen
Isotopen spelen een cruciale rol in verschillende wetenschappelijke disciplines:
- Radiometrische datering: Koolstof-14 (14C) wordt gebruikt voor radiometrische datering om de ouderdom van organische materialen te bepalen. De constante vervalsnelheid van 14C maakt het mogelijk om te bepalen hoe lang geleden een organisme is gestorven.
- Medische beeldvorming: Isotopen zoals technetium-99m (99mTc) worden gebruikt in de nucleaire geneeskunde voor diagnostische beeldvorming. De radioactieve isotopen zenden straling uit die kan worden gedetecteerd en gebruikt om beelden van organen en weefsels te maken.
- Kernenergie: Uranium-235 (235U) is een splijtstof die wordt gebruikt in kernreactoren om elektriciteit op te wekken. Wanneer een neutron op een 235U-kern botst, splitst de kern zich in kleinere kernen, waarbij energie en extra neutronen vrijkomen.
Real-World Voorbeelden en Data
Het concept van neutronen en isotopen is niet alleen theoretisch; het heeft concrete toepassingen in de echte wereld. Hier zijn enkele voorbeelden:
- De nucleaire industrie: Kerncentrales maken gebruik van de splijting van uranium-235 om warmte te genereren, die vervolgens wordt gebruikt om stoom te produceren en turbines aan te drijven. Het aantal neutronen dat vrijkomt bij de splijting van uranium-235 is cruciaal voor het in stand houden van de kettingreactie.
- De medische wereld: Radioactieve isotopen worden gebruikt voor kankertherapie. Cobalt-60 (60Co) bijvoorbeeld, zendt gammastraling uit die kankercellen kan doden. De dosering van de straling moet zorgvuldig worden gecontroleerd om gezonde cellen te sparen.
- Archeologie: Koolstof-14 datering wordt gebruikt om de ouderdom van artefacten en fossielen te bepalen. Door de hoeveelheid 14C in een monster te meten, kunnen archeologen en paleontologen schattingen maken van de leeftijd van het materiaal.
- Industriële toepassingen: Neutronenactivering wordt gebruikt om de samenstelling van materialen te analyseren. Door een monster te bestralen met neutronen, kunnen de verschillende elementen in het monster worden geïdentificeerd en gekwantificeerd op basis van de karakteristieke gammastraling die ze uitzenden.
Data over het aantal neutronen in verschillende isotopen zijn vrij beschikbaar in databases en tabellen, zoals de "Table of Isotopes". Deze bronnen bieden een uitgebreid overzicht van de eigenschappen van verschillende isotopen, inclusief hun halfwaardetijd, vervalmodi en abundance.
Conclusie: Het Belang van Begrip
Het begrijpen van hoe je het aantal neutronen in een atoom kunt bepalen, is essentieel voor het begrijpen van de basisprincipes van de chemie en natuurkunde. Het aantal neutronen beïnvloedt de stabiliteit van een atoom, de eigenschappen van elementen en de toepassingen van isotopen in diverse velden. Door het atoomnummer en het massagetal te begrijpen, kunnen we de structuur en het gedrag van materie beter begrijpen.
Aanmoediging: Verdiep je verder in de materie! Gebruik het periodiek systeem en online bronnen om te oefenen met het berekenen van het aantal neutronen in verschillende isotopen. Onderzoek de verschillende toepassingen van isotopen in de wetenschap en technologie. Een dieper begrip van deze concepten zal je waardering voor de wereld om je heen vergroten.
Bekijk ook deze gerelateerde berichten:
- Wat Is Gezegde In Een Zin
- Van Bruto Naar Netto Omrekenen
- Van Dat Voormalige Staatshoofd Is Geen Postzegel
- Hoe Maak Je Een Formule Bij Een Grafiek
- Kan Je Wiskunde Laten Vallen Op Havo
- Verschil Objectief En Subjectief Recht
- Hoeveel Brandstof Verbruikt Een Vliegtuig
- Wie Niet Steelt Of Erft Zal Werken Tot Hij Sterft
- Hoeveel Zintuigen Heeft Een Mens
- Wat Is Het Nash Evenwicht
