Wat Is Een Verbinding Scheikunde
Scheikunde, de studie van materie en haar eigenschappen, is gebouwd op de fundamentele bouwstenen van atomen. Echter, atomen zelden bestaan in isolatie. Ze neigen ertoe zich te verbinden met andere atomen en vormen zo de basis voor alles wat we om ons heen zien en zelf ervaren: verbindingen. In dit artikel duiken we diep in de wereld van chemische verbindingen, onderzoeken we wat ze zijn, hoe ze worden gevormd en de verschillende types die bestaan. We zullen proberen deze complexe materie op een begrijpelijke manier uiteen te zetten, zonder de nuances te verbergen. Het doel is om een helder inzicht te geven in een cruciaal concept binnen de chemie.
Wat is een Chemische Verbinding?
In de meest eenvoudige bewoordingen is een chemische verbinding een substantie die wordt gevormd wanneer twee of meer verschillende elementen chemisch aan elkaar gebonden zijn. Deze binding resulteert in een nieuwe substantie met eigenschappen die verschillen van die van de individuele elementen waaruit ze is opgebouwd. Het is cruciaal om te benadrukken dat de elementen chemisch gebonden moeten zijn; een simpele menging van twee elementen is geen verbinding.
Denk bijvoorbeeld aan water (H₂O). Het is een verbinding die is gevormd door de chemische reactie van waterstof (H) en zuurstof (O). Waterstof is een licht ontvlambaar gas en zuurstof ondersteunt verbranding, maar wanneer ze chemisch met elkaar reageren, vormen ze water, een vloeistof die juist gebruikt wordt om vuur te doven. Dit illustreert duidelijk hoe de eigenschappen van een verbinding significant kunnen verschillen van die van de samenstellende elementen.
Hoe Vormen Atomen Verbindingen?
Atomen vormen verbindingen om een stabielere elektronische configuratie te bereiken. De meeste atomen streven ernaar om een volledig gevulde buitenste schil (de valentieschil) te hebben. Dit streven naar stabiliteit is de drijvende kracht achter het vormen van chemische bindingen.
Er zijn voornamelijk twee manieren waarop atomen dit kunnen bereiken: door het overdragen van elektronen (waardoor ionische bindingen ontstaan) of door het delen van elektronen (waardoor covalente bindingen ontstaan).
Types Chemische Bindingen
De aard van de chemische binding die atomen verbindt, bepaalt de eigenschappen van de resulterende verbinding. Hier zijn de belangrijkste types chemische bindingen:
Ionische Bindingen
Ionische bindingen worden gevormd wanneer één of meer elektronen volledig worden overgedragen van het ene atoom naar het andere. Dit gebeurt meestal tussen een metaal en een niet-metaal. Het atoom dat elektronen verliest, wordt een positief geladen ion (een kation), terwijl het atoom dat elektronen wint, een negatief geladen ion wordt (een anion). De tegengestelde ladingen trekken elkaar aan, wat resulteert in een ionische binding.
Een klassiek voorbeeld is natriumchloride (NaCl), of keukenzout. Natrium (Na) staat een elektron af aan chloor (Cl). Natrium wordt een Na+ ion en chloor wordt een Cl- ion. De elektrostatische aantrekking tussen deze ionen vormt de ionische binding in NaCl. Ionische verbindingen hebben doorgaans hoge smelt- en kookpunten en zijn goede geleiders van elektriciteit wanneer ze zijn opgelost in water.
Covalente Bindingen
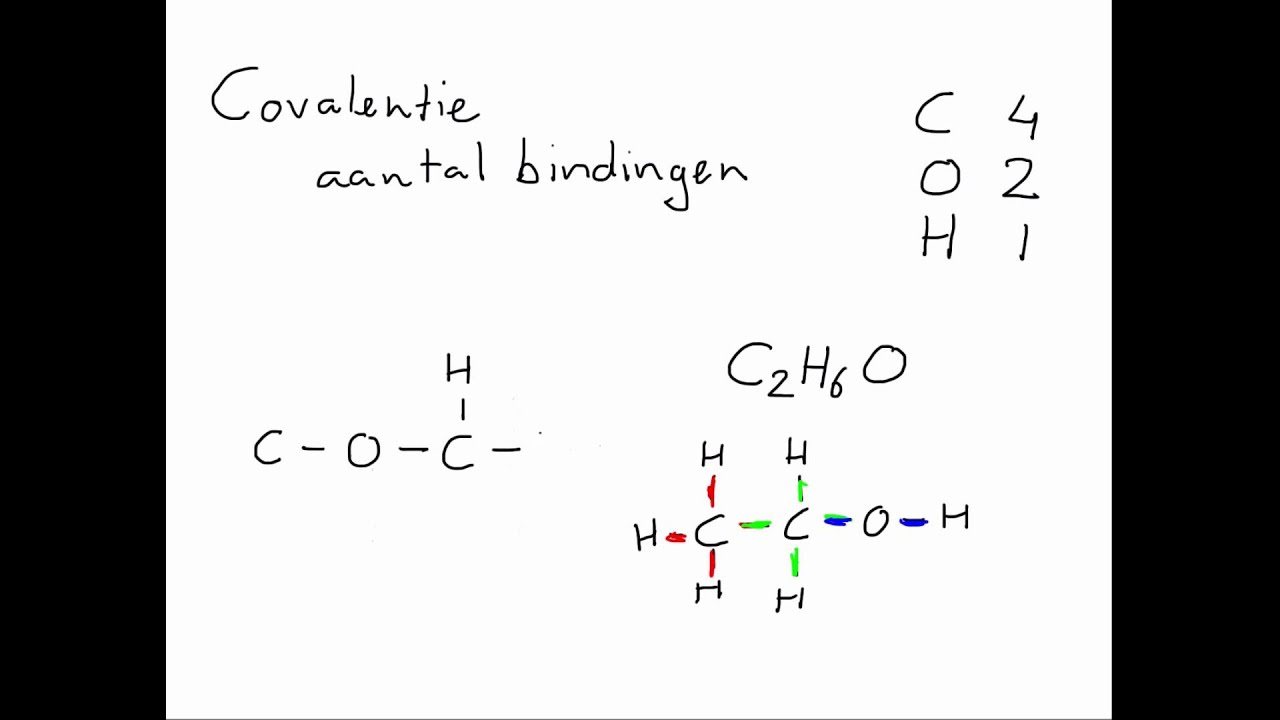
Covalente bindingen worden gevormd wanneer atomen elektronen delen in plaats van ze over te dragen. Dit gebeurt meestal tussen twee niet-metalen. De gedeelde elektronen bevinden zich in de ruimte tussen de atoomkernen en worden aangetrokken door beide kernen, wat resulteert in een stabiele binding.
Water (H₂O) is een goed voorbeeld van een verbinding met covalente bindingen. Zuurstof (O) deelt elektronen met twee waterstofatomen (H). Er zijn verschillende soorten covalente bindingen, afhankelijk van het aantal gedeelde elektronenparen:
- Enkelvoudige binding: één paar elektronen wordt gedeeld (bijv. in waterstofgas, H₂).
- Dubbele binding: twee paar elektronen worden gedeeld (bijv. in zuurstofgas, O₂).
- Drievoudige binding: drie paar elektronen worden gedeeld (bijv. in stikstofgas, N₂).
De polariteit van een covalente binding hangt af van de elektronegativiteit van de atomen. Elektronegativiteit is een maat voor het vermogen van een atoom om elektronen in een chemische binding aan te trekken. Als de elektronegativiteit van de twee atomen gelijk is, is de binding niet-polair (bijv. in H₂). Als er een significant verschil is in elektronegativiteit, is de binding polair (bijv. in H₂O). In een polaire covalente binding is er een gedeeltelijke positieve lading (δ+) op het atoom met de lagere elektronegativiteit en een gedeeltelijke negatieve lading (δ-) op het atoom met de hogere elektronegativiteit.
Metaalbindingen
Metaalbindingen zijn een ander type chemische binding, kenmerkend voor metalen. In een metaal zijn de valentie-elektronen gedelokaliseerd over het hele rooster van atomen, waardoor een "zee" van elektronen ontstaat. Deze gedelokaliseerde elektronen zorgen voor de goede elektrische en thermische geleidbaarheid van metalen, evenals hun typische glans en vervormbaarheid.
Voorbeelden van Verbindingen in de Praktijk
Verbindingen zijn overal om ons heen en spelen een cruciale rol in alle aspecten van ons leven. Hier zijn enkele voorbeelden:
- Water (H₂O): Essentieel voor alle bekende levensvormen. Het fungeert als oplosmiddel voor vele chemische reacties, reguleert de temperatuur en is een belangrijk onderdeel van ecosystemen.
- Kooldioxide (CO₂): Een belangrijk gas in de atmosfeer dat betrokken is bij fotosynthese en de regulering van de temperatuur van de aarde. Het is ook een broeikasgas, en de concentratie ervan in de atmosfeer heeft belangrijke gevolgen voor het klimaat.
- Glucose (C₆H₁₂O₆): Een eenvoudige suiker die de belangrijkste bron van energie is voor levende organismen.
- Natriumchloride (NaCl): Keukenzout, gebruikt als smaakmaker en conserveermiddel. Het is ook essentieel voor de regulering van lichaamsvloeistoffen.
- Ammoniak (NH₃): Gebruikt bij de productie van kunstmest, reinigingsmiddelen en andere chemicaliën.
De eigenschappen van deze verbindingen, zoals hun smeltpunt, kookpunt, oplosbaarheid en reactiviteit, zijn direct gerelateerd aan het type chemische bindingen die ze bevatten. Kennis van chemische verbindingen is essentieel voor het begrijpen van de wereld om ons heen.
Reacties en Verbindingen
Chemische reacties zijn processen waarbij verbindingen worden gevormd of verbroken. Tijdens een chemische reactie worden atomen gereorganiseerd en nieuwe verbindingen gevormd. De wet van behoud van massa stelt dat de massa van de reagentia (de stoffen die reageren) gelijk is aan de massa van de producten (de stoffen die worden gevormd).
Een voorbeeld is de verbranding van methaan (CH₄), het hoofdbestanddeel van aardgas. Methaan reageert met zuurstof (O₂) om kooldioxide (CO₂) en water (H₂O) te vormen:
CH₄ + 2O₂ → CO₂ + 2H₂O
In deze reactie worden de covalente bindingen in methaan en zuurstof verbroken, en nieuwe covalente bindingen worden gevormd in kooldioxide en water. De energie die bij deze reactie vrijkomt, wordt gebruikt voor verwarming en elektriciteitsproductie.
Data over Verbindingen
De chemie kent een enorme hoeveelheid data over de eigenschappen van specifieke verbindingen. Hier zijn enkele voorbeelden:
- Smeltpunt van Natriumchloride (NaCl): 801 °C
- Kookpunt van Water (H₂O): 100 °C (bij 1 atmosfeer druk)
- Oplosbaarheid van Glucose (C₆H₁₂O₆) in water: Ongeveer 91 g per 100 ml bij 25 °C
- pH van een 1M oplossing van Ammoniak (NH₃): Ongeveer 11.6
Deze data, en de enorme hoeveelheid andere bekende informatie over verbindingen, stelt wetenschappers in staat om de eigenschappen van stoffen te voorspellen, nieuwe materialen te ontwerpen en chemische processen te optimaliseren. Databases zoals PubChem en ChemSpider bieden uitgebreide informatie over miljoenen verschillende verbindingen.
Conclusie
Het concept van chemische verbindingen is fundamenteel voor het begrip van de chemie en de wereld om ons heen. Van de lucht die we inademen tot het voedsel dat we eten, en de medicijnen die ons genezen, alles bestaat uit verbindingen. Het begrijpen van de manier waarop atomen zich verbinden, de soorten bindingen die gevormd worden, en de eigenschappen van de resulterende verbindingen, is cruciaal voor het oplossen van problemen in diverse gebieden, zoals geneeskunde, materialenwetenschap en milieubeheer.
Hopelijk heeft dit artikel een helder en beknopt overzicht gegeven van wat een chemische verbinding is. Blijf leren en ontdekken! De wereld van de chemie is oneindig fascinerend en biedt talloze mogelijkheden voor innovatie en verbetering van de wereld.

Bekijk ook deze gerelateerde berichten:
- Hoeveel Zakgeld Voor 13 Jarige Per Week
- Welke Functie Heeft Glucose In Cellen
- Hoe Valt De Zomervakantie In 2024
- Wat Is Het Verschil Tussen Bruto En Netto
- Welke Leeftijd Theorie Examen Auto
- Hoe Heet De Architect Van De Erasmusbrug
- Hoeveel Atomen Zijn Er In Het Universum
- Door Welke Landen Stroomt De Amazone
- Hoelaat Moet Een Kind Van 12 Naar Bed
- Stelling Van Pythagoras Hoeken Berekenen
