Atomic Mass And Atomic Number
Laten we eerlijk zijn: scheikunde kan soms aanvoelen als een doolhof vol abstracte concepten. Je zit daar, staart naar een periodiek systeem en probeert te begrijpen wat al die getallen en symbolen nu eigenlijk betekenen. De termen atoommassa en atoomnummer komen vaak voorbij, maar wat zijn ze precies en waarom zijn ze zo belangrijk?
Dit artikel is bedoeld om je door die verwarring heen te loodsen. We gaan niet alleen de definities behandelen, maar ook kijken naar de praktische implicaties van deze concepten in de echte wereld. Geen ingewikkelde formules, maar heldere uitleg en concrete voorbeelden. Laten we de mysterie van atoommassa en atoomnummer samen ontrafelen!
Atoomnummer: De Identiteit van een Element
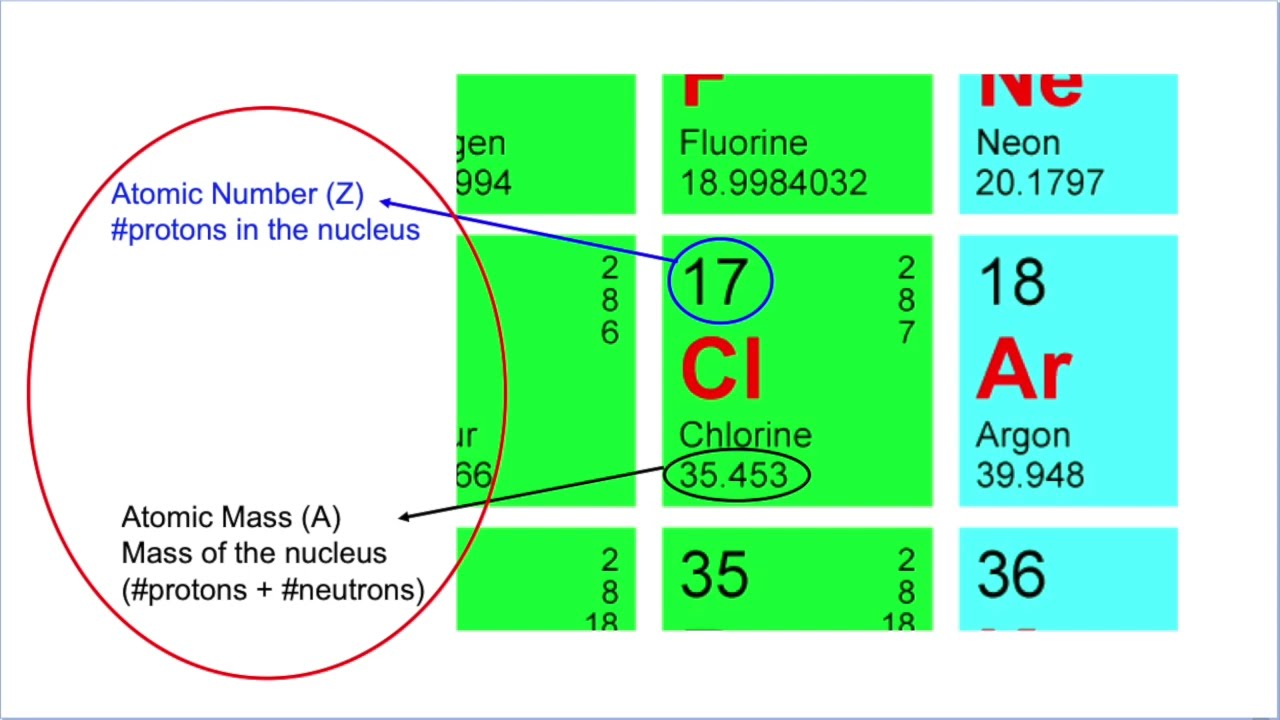
Het atoomnummer is, in essentie, de identiteitskaart van een element. Het vertelt ons iets fundamenteels over de structuur van een atoom:
- Het atoomnummer is gelijk aan het aantal protonen in de kern van een atoom.
- Elk element heeft een uniek atoomnummer. Waterstof (H) heeft atoomnummer 1, helium (He) heeft atoomnummer 2, lithium (Li) heeft atoomnummer 3, enzovoort.
- Het atoomnummer bepaalt de chemische eigenschappen van een element.
Stel je voor: elk element is een uniek persoon met een eigen paspoort (het atoomnummer). Het paspoort bevat informatie die die persoon definieert. Zo definieert het atoomnummer een element. Verander het atoomnummer, en je verandert het element zelf!
Waarom is het aantal protonen zo belangrijk? Omdat protonen een positieve lading hebben. In een neutraal atoom is het aantal protonen gelijk aan het aantal elektronen (die een negatieve lading hebben) waardoor het atoom als geheel elektrisch neutraal is. De elektronen bepalen hoe een atoom reageert met andere atomen, dus het aantal protonen indirect ook. Dit is de basis van alle chemische reacties die we kennen!
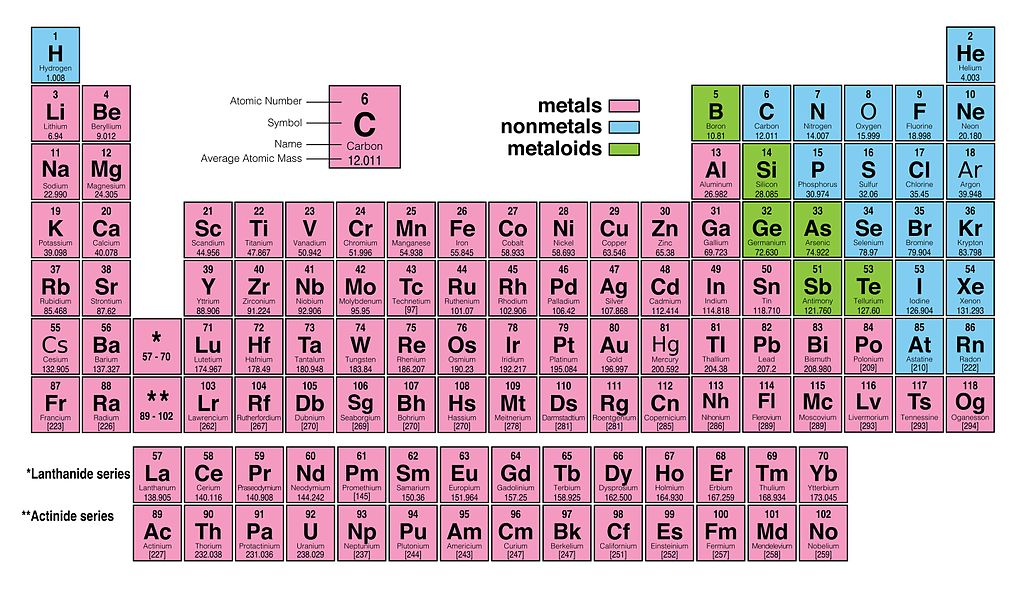
Atoomnummer en het Periodiek Systeem
Het periodiek systeem is georganiseerd op basis van oplopend atoomnummer. Dit is geen toeval. De elementen zijn gerangschikt op een manier die hun chemische eigenschappen weerspiegelt. Elementen in dezelfde kolom (groep) hebben vergelijkbare eigenschappen omdat ze een vergelijkbare elektronische structuur hebben.
Als je naar het periodiek systeem kijkt, zie je dat elk element een eigen vakje heeft met een symbool (bijvoorbeeld H voor waterstof, O voor zuurstof) en een getal (het atoomnummer). Het atoomnummer is vaak linksboven in het vakje geplaatst.
Atoommassa: Het Gewicht van een Atoom
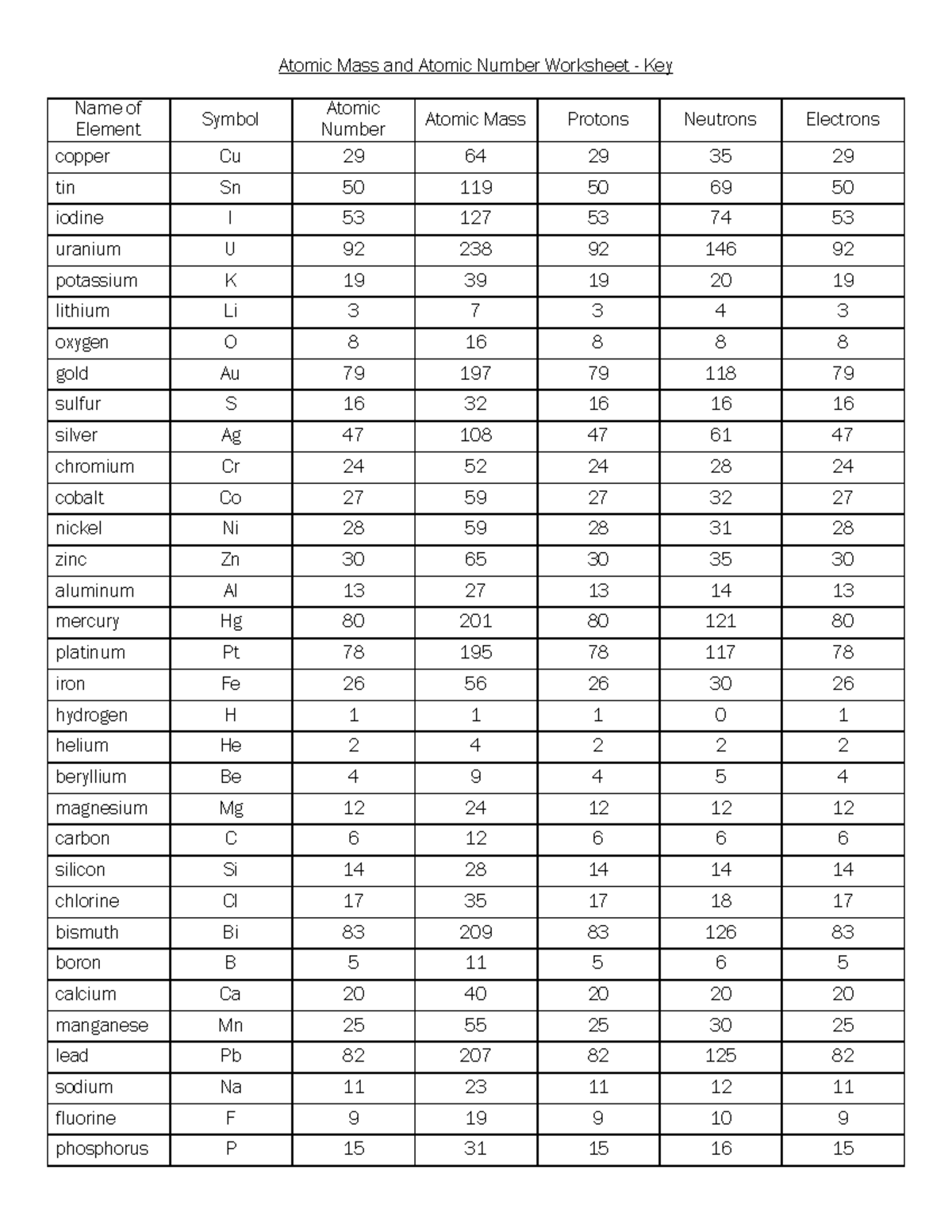
De atoommassa is de relatieve massa van een atoom, uitgedrukt in atomaire massa-eenheden (amu). Eén amu is gedefinieerd als 1/12 van de massa van een koolstof-12 atoom. Het geeft ons een indicatie van hoe "zwaar" een atoom is in vergelijking met andere atomen.
Het is belangrijk op te merken dat de atoommassa niet hetzelfde is als het massagetal. Het massagetal is de som van het aantal protonen en neutronen in de kern van een atoom. De atoommassa is een gewogen gemiddelde van de massa's van alle isotopen van een element, rekening houdend met hun relatieve abundantie.
- De atoommassa wordt voornamelijk bepaald door de massa van de protonen en neutronen in de kern. Elektronen dragen relatief weinig bij aan de totale massa.
- Isotopen zijn atomen van hetzelfde element (zelfde atoomnummer) met een verschillend aantal neutronen. Dit leidt tot verschillende massagetallen.
- De atoommassa die je in het periodiek systeem ziet, is het gewogen gemiddelde van de isotopen.
Stel je voor dat je verschillende soorten appels hebt: groene, rode en gele. Elk type appel heeft een iets ander gewicht. De gemiddelde massa van alle appels in je mand is vergelijkbaar met de atoommassa. Je neemt de massa van elk type appel, vermenigvuldigt dat met het percentage van dat type appel in de mand, en telt alles bij elkaar op.
Isotopen en Relatieve Abundantie
Zoals gezegd zijn isotopen atomen van hetzelfde element met een verschillend aantal neutronen. Dit betekent dat ze hetzelfde atoomnummer hebben (hetzelfde aantal protonen), maar een verschillend massagetal (verschillend aantal neutronen).
Bijvoorbeeld, koolstof (C) heeft atoomnummer 6. Dat betekent dat elk koolstofatoom 6 protonen heeft. Koolstof komt echter in verschillende isotopen voor:
- Koolstof-12 (12C): 6 protonen en 6 neutronen
- Koolstof-13 (13C): 6 protonen en 7 neutronen
- Koolstof-14 (14C): 6 protonen en 8 neutronen
De relatieve abundantie is het percentage van elk isotoop dat van nature voorkomt. Koolstof-12 is de meest voorkomende isotoop (ongeveer 98.9%), terwijl koolstof-13 en koolstof-14 in veel kleinere hoeveelheden voorkomen.
De atoommassa van koolstof die je in het periodiek systeem ziet (ongeveer 12.01 amu) is het gewogen gemiddelde van de massa's van deze isotopen, rekening houdend met hun relatieve abundantie.
Het Belang in de Praktijk
Atoommassa en atoomnummer zijn niet alleen theoretische concepten; ze hebben belangrijke toepassingen in verschillende vakgebieden:
- Chemie: Ze worden gebruikt om chemische reacties te begrijpen en te voorspellen, om stoichiometrische berekeningen uit te voeren (bijvoorbeeld hoeveel reactant je nodig hebt om een bepaalde hoeveelheid product te maken), en om de eigenschappen van stoffen te verklaren.
- Natuurkunde: Ze zijn essentieel voor het bestuderen van atoomkernfysica, nucleaire reacties en radioactiviteit. Bijvoorbeeld, radioactieve datering (zoals koolstof-14 datering) maakt gebruik van het feit dat koolstof-14 vervalt met een bekende halveringstijd.
- Biologie: Isotopen worden gebruikt in medisch onderzoek en diagnostiek, bijvoorbeeld in PET-scans (Positron Emissie Tomografie) om de activiteit van organen en weefsels te meten.
- Geologie: Isotopen worden gebruikt om de leeftijd van gesteenten en mineralen te bepalen, en om de oorsprong en de processen te bestuderen die deze gesteenten hebben gevormd.
- Materiaalkunde: De eigenschappen van materialen zijn afhankelijk van de atomaire structuur, dus kennis van atoommassa en atoomnummer is cruciaal bij het ontwerpen en ontwikkelen van nieuwe materialen.
Denk bijvoorbeeld aan de ontwikkeling van medicijnen. Wetenschappers gebruiken hun kennis van atoommassa en atoomnummer om moleculen te ontwerpen die specifiek interageren met bepaalde doelwitten in het lichaam. Of denk aan de ontwikkeling van duurzame energiebronnen, zoals zonnecellen. De efficiëntie van zonnecellen is afhankelijk van de atomaire structuur van de materialen waaruit ze zijn gemaakt.
Counterpoints: Is Atoommassa Altijd Constant?
Hoewel de atoommassa van een element over het algemeen constant is, kunnen er kleine variaties optreden als gevolg van:
- Isotopische fractie: In sommige gevallen kan de relatieve abundantie van isotopen enigszins variëren, afhankelijk van de bron van het element. Dit kan leiden tot kleine verschillen in de gemeten atoommassa.
- Massa-defect: De massa van een atoomkern is iets kleiner dan de som van de massa's van de individuele protonen en neutronen. Dit komt door de bindende energie die de nucleonen bij elkaar houdt (E=mc2). Dit effect is echter meestal klein en verwaarloosbaar.
Deze kleine variaties hebben echter over het algemeen geen significante invloed op de meeste chemische en fysische toepassingen.
Conclusie
We hebben nu de basisprincipes van atoommassa en atoomnummer behandeld. Het atoomnummer definieert de identiteit van een element door het aantal protonen in de kern, terwijl de atoommassa de relatieve massa van een atoom aangeeft, rekening houdend met de isotopen en hun abundantie.
Deze concepten zijn niet alleen belangrijk voor scheikundigen en natuurkundigen, maar ze spelen ook een cruciale rol in diverse toepassingen, van medisch onderzoek tot materiaalkunde. Het begrijpen van atoommassa en atoomnummer geeft je een dieper inzicht in de wereld om ons heen, op de meest fundamentele schaal.
Wat ga jij nu doen met deze nieuwe kennis? Ga je het periodiek systeem eens nader bestuderen? Of ga je op zoek naar voorbeelden van toepassingen van isotopen in jouw interessegebied?
Bekijk ook deze gerelateerde berichten:
- Steken In Hart Bij Inademen
- Star Wars Iii Revenge Of The Sith
- Is De Zon Ook Een Ster
- Theatervorm Waar Niet Gesproken Wordt
- Wondjes In Mond Sneller Genezen
- Engels Boek Over Een Bos
- Graag Ontvang Ik Een Bevestiging Van Ontvangst
- Hoesten Tijdens Eten En Drinken
- Ik Heb In Het Frans
- Schema Eten Baby 6 Maanden
