Chemie Overal Antwoorden Havo 3
Scheikunde, of chemie, is overal om ons heen. Van het ademen van zuurstof tot het bakken van een cake, chemische reacties spelen een cruciale rol in ons dagelijks leven. Voor leerlingen in 3 Havo kan het vak echter soms uitdagend zijn. De leerstof van Chemie Overal is specifiek ontworpen om de basisprincipes van de chemie op een begrijpelijke manier over te brengen. In dit artikel gaan we dieper in op enkele belangrijke concepten uit de methode en hoe deze terugkomen in de antwoorden op opdrachten.
Belangrijke Concepten in Chemie Overal Havo 3
De Bouw van Stoffen
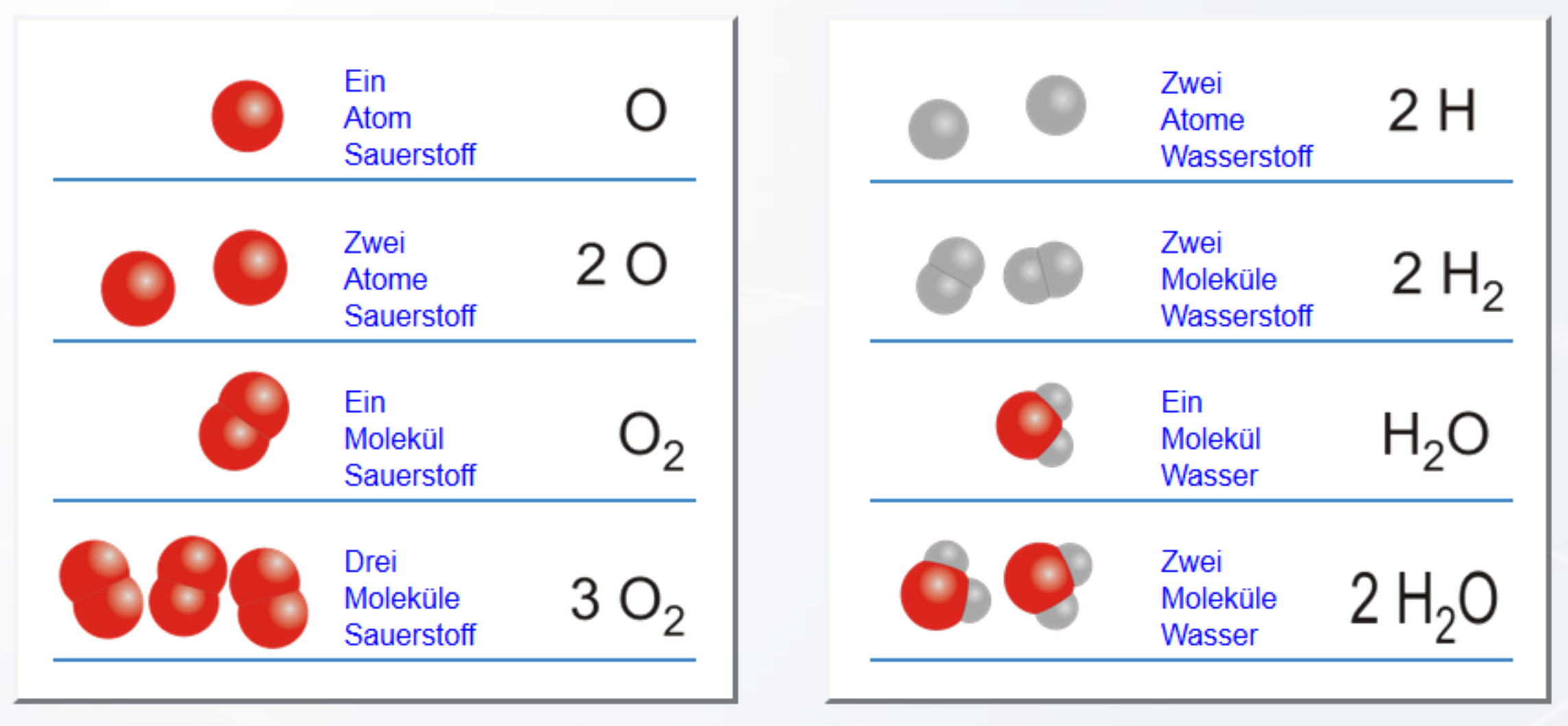
Een fundamenteel concept is het begrijpen van de bouw van stoffen. Alles om ons heen is opgebouwd uit atomen, de kleinste deeltjes van een element. Deze atomen verbinden zich met elkaar om moleculen te vormen. Chemie Overal legt uit hoe verschillende soorten bindingen ontstaan, zoals covalente bindingen (bindingen waarbij atomen elektronen delen) en ionbindingen (bindingen waarbij elektronen worden overgedragen tussen atomen, wat resulteert in ionen).
De eigenschappen van een stof worden sterk bepaald door de aard van de bindingen tussen de atomen en de structuur van het molecuul. Bijvoorbeeld, water (H2O) heeft sterke waterstofbruggen tussen de moleculen, wat resulteert in een relatief hoog kookpunt.
Voorbeeld: De opbouw van keukenzout (natriumchloride, NaCl). Natrium (Na) staat een elektron af aan chloor (Cl), waardoor Na+ en Cl- ionen ontstaan. Deze ionen trekken elkaar aan en vormen een ionrooster, wat de hardheid en het hoge smeltpunt van zout verklaart.
Chemische Reacties
Een chemische reactie is het proces waarbij atomen en moleculen zich anders ordenen, wat resulteert in de vorming van nieuwe stoffen. Chemie Overal behandelt verschillende soorten reacties, zoals verbrandingsreacties, ontledingsreacties, neutralisatiereacties en redoxreacties.
Het is essentieel om reactievergelijkingen correct te kunnen opstellen en balanceren. Dit vereist het begrijpen van de wet van behoud van massa, die stelt dat het aantal atomen van elk element aan beide zijden van de reactievergelijking gelijk moet zijn.
Voorbeeld: De verbranding van methaan (CH4). De reactievergelijking is: CH4 + 2O2 → CO2 + 2H2O. Dit laat zien dat methaan reageert met zuurstof om koolstofdioxide en water te vormen. Het is belangrijk dat de vergelijking gebalanceerd is; er zijn evenveel C-, H- en O-atomen aan beide kanten.
Zuren en Basen
Zuren en basen zijn stoffen met specifieke eigenschappen. Zuren hebben een zure smaak (pas op: proef nooit aan chemische stoffen!), kunnen metalen aantasten en verkleuren bepaalde kleurstoffen. Basen voelen vaak zeepachtig aan, hebben een bittere smaak en kunnen zuren neutraliseren.
Chemie Overal legt uit wat de pH-schaal is, een maat voor de zuurgraad van een oplossing. Een pH van 7 is neutraal, lager dan 7 is zuur en hoger dan 7 is basisch. De sterkte van een zuur of base hangt af van de mate waarin het dissocieert in water.
Voorbeeld: Citroensap is een zuur met een lage pH, terwijl zeep een base is met een hoge pH. Een reactie tussen een zuur en een base, zoals zoutzuur (HCl) en natronloog (NaOH), is een neutralisatiereactie die zout (NaCl) en water (H2O) vormt: HCl + NaOH → NaCl + H2O.
Rekenen aan Reacties (Stoechiometrie)
Stoechiometrie is de tak van de chemie die zich bezighoudt met de kwantitatieve relaties tussen reactanten en producten in een chemische reactie. Met andere woorden, het helpt ons te berekenen hoeveel van een bepaalde stof we nodig hebben of kunnen produceren in een reactie.
Een cruciale eenheid hierbij is de mol. Eén mol van een stof bevat 6,022 x 1023 deeltjes (de constante van Avogadro). Door de molaire massa van stoffen te kennen (de massa van één mol van die stof), kunnen we massa omrekenen naar mol en vice versa.
Voorbeeld: Stel dat we willen weten hoeveel gram zuurstof er nodig is om 10 gram methaan (CH4) volledig te verbranden. Eerst berekenen we het aantal mol methaan: molaire massa CH4 = 16 g/mol, dus 10 g CH4 = 10/16 = 0,625 mol. Volgens de reactievergelijking CH4 + 2O2 → CO2 + 2H2O, is er 2 mol O2 nodig per mol CH4. Dus we hebben 0,625 mol * 2 = 1,25 mol O2 nodig. De molaire massa van O2 is 32 g/mol, dus 1,25 mol O2 = 1,25 * 32 = 40 gram O2.
Oplossingen en Concentraties
Een oplossing is een homogeen mengsel van twee of meer stoffen. De stof die in grotere hoeveelheid aanwezig is, wordt het oplosmiddel genoemd, en de stof die in kleinere hoeveelheid aanwezig is, wordt de opgeloste stof genoemd.
Concentratie is een maat voor de hoeveelheid opgeloste stof in een bepaalde hoeveelheid oplosmiddel of oplossing. Een veelgebruikte eenheid voor concentratie is molariteit (M), gedefinieerd als het aantal mol opgeloste stof per liter oplossing (mol/L).
Voorbeeld: Als we 0,5 mol keukenzout (NaCl) oplossen in voldoende water om 1 liter oplossing te maken, dan is de concentratie van de oplossing 0,5 M. Om te berekenen hoeveel gram zout we nodig hebben, gebruiken we de molaire massa van NaCl (58,5 g/mol): 0,5 mol * 58,5 g/mol = 29,25 gram NaCl.
Antwoorden op Vraagstukken in Chemie Overal
De antwoorden op de vraagstukken in Chemie Overal vereisen vaak een combinatie van de bovenstaande concepten. Het is belangrijk om de vragen zorgvuldig te lezen en te identificeren welke informatie relevant is. Maak een stappenplan:
- Begrijp de vraag: Wat wordt er precies gevraagd?
- Gegevens verzamelen: Welke informatie wordt gegeven?
- Relevante concepten: Welke chemische principes zijn van toepassing?
- Berekeningen uitvoeren: Gebruik de juiste formules en eenheden.
- Controleren: Is het antwoord logisch en consistent met de vraag?
Voorbeeld: Een vraag over het berekenen van de pH van een zure oplossing. De stappen zouden zijn: (1) Begrijp dat je de pH moet bepalen; (2) verzamel de gegeven concentratie van het zuur; (3) herinner je de formule voor het berekenen van pH (-log[H+]); (4) voer de berekening uit; (5) controleer of de pH-waarde overeenkomt met de verwachtingen (een zuur heeft een pH lager dan 7).
Real-World Voorbeelden en Data
Chemie is overal, en Chemie Overal probeert dit te illustreren met voorbeelden uit het dagelijks leven. Denk aan:
- Voedselbereiding: Het rijzen van brood (CO2 productie), het bruinen van vlees (Maillard reactie).
- Medicijnen: De werking van pijnstillers, antibiotica en vaccins berust op chemische reacties in het lichaam.
- Materialen: De eigenschappen van kunststoffen, metalen en keramiek worden bepaald door hun chemische structuur.
- Milieu: Zure regen, broeikaseffect en luchtvervuiling zijn allemaal chemische problemen die aandacht vereisen.
Door chemie in een bredere context te plaatsen, wordt het vak relevanter en interessanter voor leerlingen. Het begrijpen van de chemische principes achter deze fenomenen helpt ons om de wereld om ons heen beter te begrijpen en om oplossingen te vinden voor belangrijke uitdagingen.
Conclusie en Call to Action
Chemie Overal Havo 3 biedt een solide basis voor het begrijpen van de chemie. Door de belangrijkste concepten te beheersen, oefenopgaven te maken en de theorie in verband te brengen met de praktijk, kunnen leerlingen succesvol zijn in dit vak.
Advies: Blijf oefenen! Chemie vereist herhaling en toepassing. Probeer ook verder te kijken dan het lesboek. Zoek online naar interessante artikelen of video's over chemie. Bespreek lastige onderwerpen met je docent of medeleerlingen. Door actief met de stof bezig te zijn, zul je de chemie beter begrijpen en waarderen.
Chemie is niet alleen een vak, het is een manier om de wereld te begrijpen. Met de juiste inspanning en motivatie kan iedereen de basisprincipes van de chemie onder de knie krijgen en de schoonheid en relevantie van dit fascinerende vak ontdekken.

Bekijk ook deze gerelateerde berichten:
- Star Wars Episode Iv A New Hope
- Short Story Story Of An Hour
- Is Er Een Dienstplicht In Nederland
- Donor Worden Voor En Nadelen
- Bpm Auto Importeren Uit Duitsland
- Op Welke Dag Is Pasen
- Ones Upon A Time In The West
- Hoeveel Geld Krijgt Iedereen Bij Monopoly
- Leen En Mertens Praktijkgericht Onderzoek
- Hoeveel Houd Je Netto Over
