Chemie Overal Antwoorden Vwo 4
Chemie Overal is een veelgebruikt scheikunde lesmethode in het voortgezet wetenschappelijk onderwijs (vwo) in Nederland. Voor 4 vwo is het een cruciaal jaar waarin de basis voor meer complexe concepten wordt gelegd. Het correct begrijpen en toepassen van de leerstof is essentieel voor succes in de vervolgjaren en latere studie. Dit artikel duikt in de kernconcepten van de Chemie Overal lesmethode voor 4 vwo, bespreekt veelvoorkomende vragen en moeilijkheden, en geeft inzicht in hoe deze kennis in de praktijk wordt gebruikt. Het doel is om leerlingen te helpen de stof beter te begrijpen en met vertrouwen te werken aan de opdrachten en examens.
Stofhoeveelheid en Reactievergelijkingen
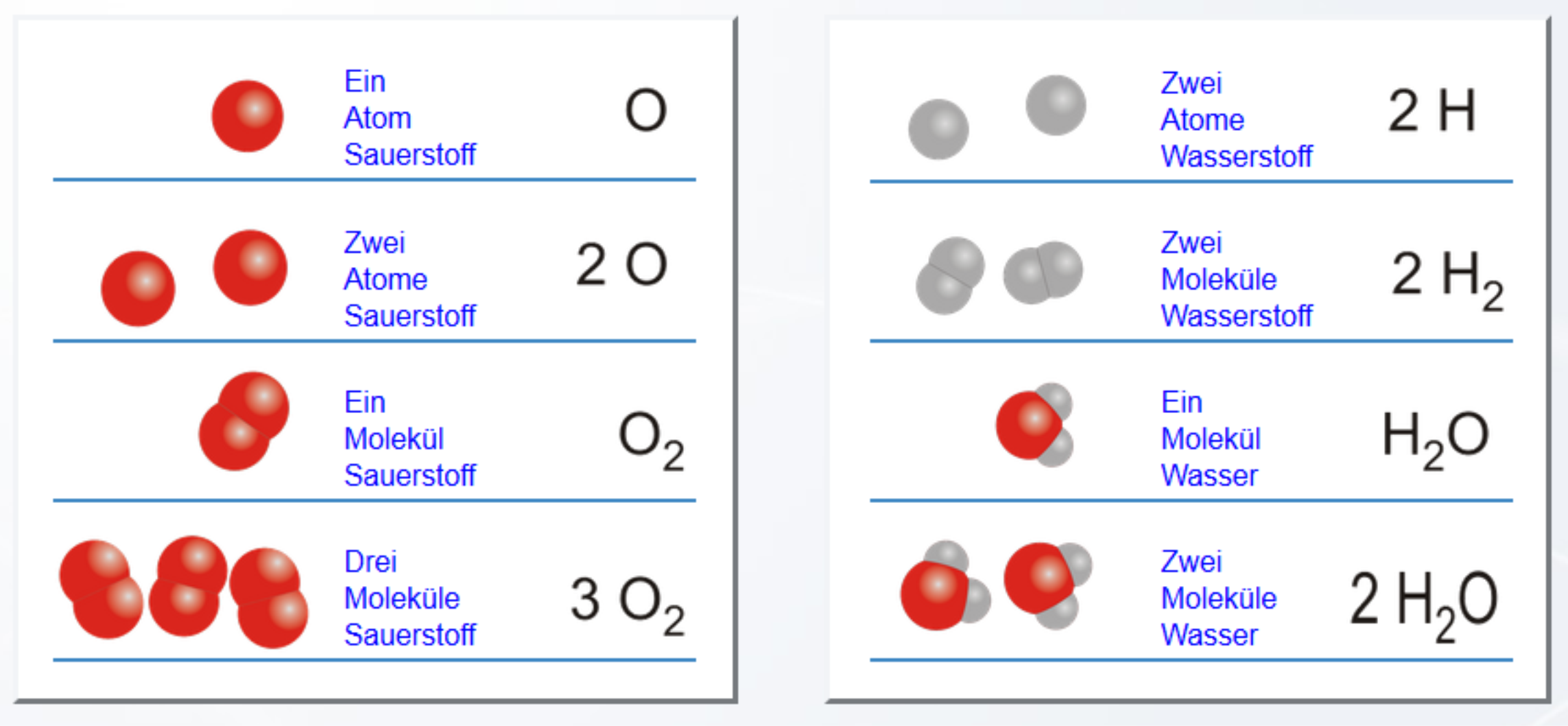
Een fundamenteel concept in de chemie is de stofhoeveelheid, uitgedrukt in mol. Leerlingen leren hoe ze de molmassa van stoffen kunnen berekenen en hoe ze de stofhoeveelheid kunnen gebruiken om massa's en volumes om te rekenen. Dit is belangrijk voor het begrijpen van reactievergelijkingen, waarbij de verhoudingen tussen reagerende stoffen en reactieproducten worden weergegeven.
Het Belang van Stoichiometrie
Stoichiometrie, de leer van de kwantitatieve relaties in chemische reacties, is essentieel. Leerlingen leren hoe ze reactievergelijkingen kloppend kunnen maken, wat betekent dat het aantal atomen van elk element aan beide kanten van de vergelijking gelijk moet zijn. Dit zorgt ervoor dat de wet van behoud van massa wordt nageleefd.
Een veelgemaakte fout is het negeren van de coëfficiënten in de reactievergelijking bij het berekenen van de benodigde of geproduceerde hoeveelheden stoffen. Bijvoorbeeld, in de reactie 2H2 + O2 → 2H2O, betekent de coëfficiënt "2" voor H2 dat er twee mol waterstofgas reageren met één mol zuurstofgas.
Voorbeeld: Stel je wilt berekenen hoeveel gram zuurstofgas (O2) nodig is om 4 gram waterstofgas (H2) volledig te laten reageren. Eerst bereken je de stofhoeveelheid waterstofgas: 4 g / 2.02 g/mol (molmassa H2) ≈ 1.98 mol. Vervolgens gebruik je de reactievergelijking om te zien dat 1 mol zuurstofgas nodig is voor 2 mol waterstofgas. Dus heb je 1.98 mol / 2 = 0.99 mol zuurstofgas nodig. Tenslotte bereken je de massa zuurstofgas: 0.99 mol * 32 g/mol (molmassa O2) ≈ 31.68 g.
Zuren en Basen
Een ander belangrijk thema is de zuur-base chemie. Leerlingen leren over de definities van zuren en basen (Arrhenius, Brønsted-Lowry), de pH-schaal, en neutralisatiereacties. Het begrijpen van de eigenschappen van sterke en zwakke zuren en basen is cruciaal.
pH-berekeningen en Indicatoren
Het berekenen van de pH van een oplossing is een belangrijke vaardigheid. Leerlingen leren hoe ze de pH kunnen berekenen op basis van de concentratie van H+ of OH- ionen. Daarnaast wordt er aandacht besteed aan indicatoren, stoffen die van kleur veranderen afhankelijk van de pH van de omgeving.
Een veelvoorkomende verwarring is het verschil tussen sterke en geconcentreerde zuren. Een sterk zuur dissocieert volledig in water, terwijl een geconcentreerd zuur een hoge molariteit heeft. Je kunt dus een verdund sterk zuur hebben (lage concentratie, maar volledig dissociatie) en een geconcentreerd zwak zuur (hoge concentratie, maar gedeeltelijke dissociatie).
Voorbeeld: Stel je hebt een oplossing van zoutzuur (HCl) met een concentratie van 0.1 M. Omdat HCl een sterk zuur is, dissocieert het volledig, dus [H+] = 0.1 M. De pH kan dan berekend worden als pH = -log[H+] = -log(0.1) = 1.
Redoxreacties
Redoxreacties, reacties waarbij elektronen worden uitgewisseld, zijn een ander belangrijk onderwerp. Leerlingen leren hoe ze oxidatiegetallen kunnen toekennen aan atomen in een molecuul of ion, en hoe ze kunnen bepalen welke stof geoxideerd en gereduceerd wordt.
Oxidatiegetallen en Redoxkoppels
Het correct toekennen van oxidatiegetallen is essentieel voor het identificeren van redoxreacties. Leerlingen leren de regels voor het toekennen van oxidatiegetallen en hoe ze deze kunnen gebruiken om redoxkoppels te identificeren. Een redoxkoppel bestaat uit een geoxideerde en een gereduceerde vorm van dezelfde stof.
Een typische fout is het vergeten dat de som van de oxidatiegetallen in een neutraal molecuul nul moet zijn, en in een ion gelijk aan de lading van het ion. Ook is het belangrijk om de eenvoudige regels voor oxidatiegetallen (zoals zuurstof is -2, tenzij in een peroxide) correct toe te passen.
Voorbeeld: Beschouw de reactie: Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s). Het oxidatiegetal van Zn verandert van 0 naar +2, dus Zn wordt geoxideerd. Het oxidatiegetal van Cu verandert van +2 naar 0, dus Cu2+ wordt gereduceerd. Zn is dus de reductor en Cu2+ is de oxidator.
Rekenen aan Oplossingen
Het berekenen van concentraties van oplossingen, uitgedrukt in molariteit (mol/L) of massaprocent, is een belangrijk onderdeel van het curriculum. Leerlingen leren hoe ze oplossingen kunnen verdunnen en hoe ze de benodigde hoeveelheid stof kunnen berekenen om een oplossing met een bepaalde concentratie te maken.
Verdunnen en Titraties
Het correct toepassen van de verdunningsformule (M1V1 = M2V2) is essentieel. Daarnaast wordt er aandacht besteed aan titraties, een methode om de concentratie van een oplossing te bepalen door deze te laten reageren met een oplossing van bekende concentratie.
Een veelgemaakte fout is het vergeten om de juiste eenheden te gebruiken bij het berekenen van concentraties. Zorg ervoor dat je consistent bent met liters en mol. Bij titraties is het belangrijk om de reactievergelijking te gebruiken om de juiste stoichiometrische verhouding te bepalen.
Voorbeeld: Stel je wilt 250 mL van een 0.2 M NaCl oplossing maken uit een 1.0 M NaCl oplossing. Gebruik de verdunningsformule: (1.0 M)(V1) = (0.2 M)(0.250 L). V1 = (0.2 M * 0.250 L) / 1.0 M = 0.050 L = 50 mL. Dus je moet 50 mL van de 1.0 M oplossing verdunnen tot 250 mL met water.
Kinetiek en Evenwicht
De kinetiek bestudeert de snelheid van chemische reacties en de factoren die deze beïnvloeden. Het chemisch evenwicht beschrijft de toestand waarin de snelheid van de heengaande en teruggaande reactie gelijk is, resulterend in een constante samenstelling van het reactiemengsel.
Factoren die Reactiesnelheid Beïnvloeden en Le Chatelier
Leerlingen leren over factoren zoals temperatuur, concentratie, katalysatoren en oppervlakte die de reactiesnelheid beïnvloeden. Daarnaast wordt de wet van Le Chatelier behandeld, die beschrijft hoe een systeem in evenwicht reageert op veranderingen in temperatuur, druk of concentratie.
Een belangrijke misvatting is dat een katalysator de ligging van het evenwicht verandert. Een katalysator versnelt alleen de reactie, zowel de heengaande als de teruggaande, waardoor het evenwicht sneller wordt bereikt, maar de uiteindelijke verhouding van reactanten en producten blijft hetzelfde.
Voorbeeld: Beschouw het Haber-Bosch proces voor de synthese van ammoniak: N2(g) + 3H2(g) ⇌ 2NH3(g) + warmte. Volgens Le Chatelier zal het verhogen van de druk het evenwicht verschuiven naar de kant met minder gasmoleculen (de rechterkant, NH3), waardoor de opbrengst aan ammoniak toeneemt. Het verlagen van de temperatuur (aangezien de reactie exotherm is) zal ook de vorming van ammoniak bevorderen.
Toepassingen in het Dagelijks Leven en Industrie
Chemie is overal om ons heen, en de concepten die in Chemie Overal 4 vwo worden behandeld, hebben talloze toepassingen in het dagelijks leven en in de industrie. Van het begrijpen van de werking van batterijen (redoxreacties) tot het produceren van medicijnen (organische chemie) en het zuiveren van water (zuur-base chemie), de chemie speelt een cruciale rol.
Voorbeelden uit de Praktijk
De principes van chemisch evenwicht worden gebruikt in de voedingsindustrie om de optimale omstandigheden te bepalen voor het produceren van bepaalde voedingsmiddelen, zoals bier of kaas. Redoxreacties zijn essentieel voor de productie van metalen uit ertsen. Zuur-base reacties worden gebruikt in reinigingsmiddelen en bij het reguleren van de pH in aquaria.
Door de theorie te koppelen aan praktische toepassingen, wordt de stof relevanter en interessanter voor leerlingen. Dit helpt hen om de concepten beter te begrijpen en te onthouden.
Conclusie en Aanbevelingen
De Chemie Overal lesmethode voor 4 vwo legt een belangrijke basis voor verdere studie in de chemie. Het is essentieel om de basisconcepten, zoals stofhoeveelheid, zuur-base chemie, redoxreacties, oplossingen en kinetiek/evenwicht, goed te begrijpen. Door veel te oefenen met opgaven, de theorie te koppelen aan praktische voorbeelden, en hulp te zoeken bij moeilijkheden, kunnen leerlingen succesvol zijn in dit vak. Blijf oefenen, stel vragen en zoek naar toepassingen van de chemie in je dagelijks leven. Succes met je studie!

Bekijk ook deze gerelateerde berichten:
- 50 Staten Van Amerika Quiz
- Graden Celsius Omrekenen Naar Fahrenheit
- Met Welke Kleuren Maak Je Geel
- Wat Is De Hoofdstad Van Peru
- Hoe Vaak Is De 11 Stedentocht Gereden
- Kngf Evidence Statement Subacromiale Klachten
- Meegaan Of Mee Gaan
- Hoeveel Groter Is De Zon Dan De Aarde
- Hoe Ben Ik In Mijn Vorige Leven Overleden
- Bijdorplaan 15 2015 Ce Haarlem
