Verbinding Zuurstof Met Ander Scheikundig Element
De verbinding van zuurstof met andere chemische elementen is een fundamenteel proces in de chemie, met diepgaande gevolgen voor ons begrip van de wereld om ons heen. Van het roesten van ijzer tot de ademhaling van levende organismen, zuurstof speelt een cruciale rol in een enorme verscheidenheid aan chemische reacties. Dit artikel duikt in de complexiteit van deze verbindingen, de factoren die ze beïnvloeden en hun betekenis in verschillende contexten.
De Basis: Zuurstof en Elektronegativiteit
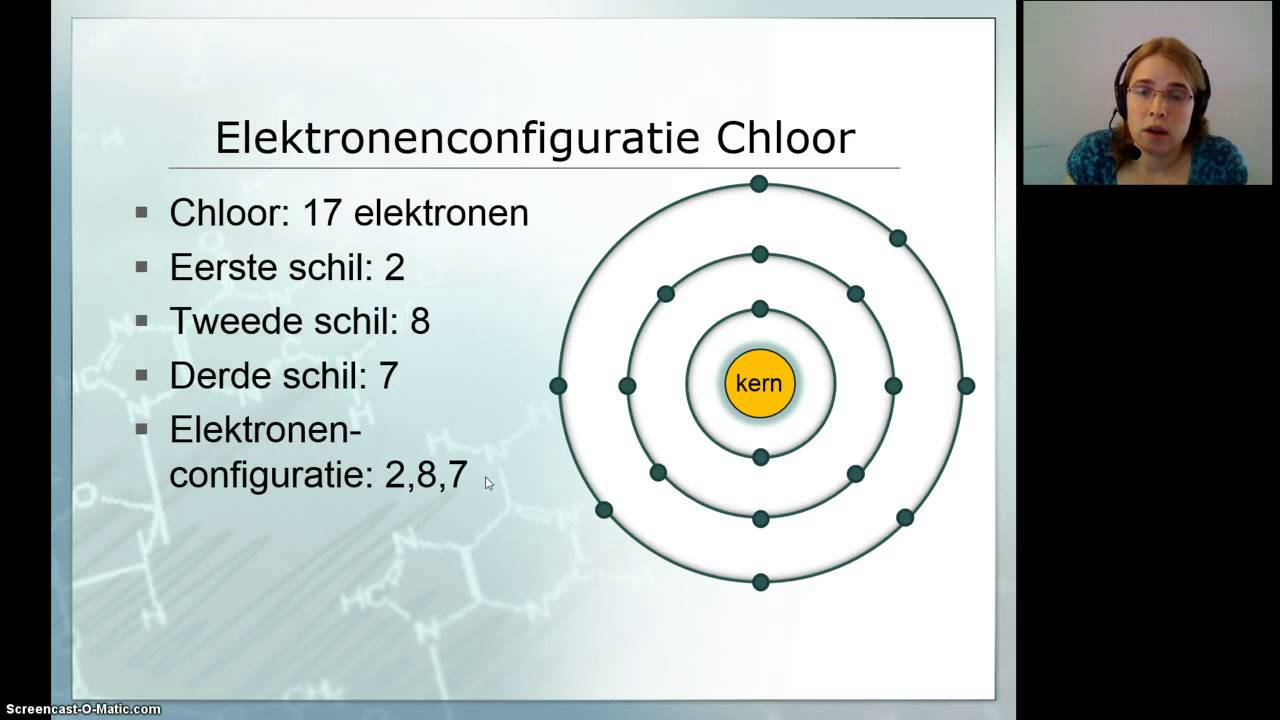
Zuurstof (O) is een zeer reactief niet-metaal dat zich bevindt in groep 16 (de chalcogenen) van het periodiek systeem. De reactiviteit van zuurstof komt voort uit zijn elektronische configuratie. Zuurstof heeft zes valentie-elektronen, wat betekent dat het graag twee extra elektronen wil opnemen om een stabiele octetconfiguratie te bereiken, zoals de edelgassen. Deze behoefte aan elektronen maakt zuurstof een sterke oxidator.
Een belangrijk concept hier is elektronegativiteit. Elektronegativiteit is de mate waarin een atoom in een chemische binding de elektronen naar zich toe trekt. Zuurstof heeft een hoge elektronegativiteit (3.44 op de Pauling-schaal), wat betekent dat het elektronen sterker aantrekt dan de meeste andere elementen. Dit resulteert vaak in de vorming van polaire covalente bindingen of ionische bindingen wanneer zuurstof zich bindt aan andere elementen.
Typen Bindingen met Zuurstof
Zuurstof kan verschillende soorten bindingen vormen, afhankelijk van het element waarmee het reageert.
- Ionische Bindingen: Wanneer zuurstof reageert met metalen met een lage elektronegativiteit, zoals natrium (Na) of magnesium (Mg), kunnen elektronen volledig worden overgedragen van het metaal naar zuurstof. Dit resulteert in de vorming van positief geladen metaalionen (kationen) en negatief geladen zuurstofionen (anionen), ook wel oxide-ionen (O2-) genoemd. Een voorbeeld is natriumoxide (Na2O), gevormd door de reactie van natrium met zuurstof.
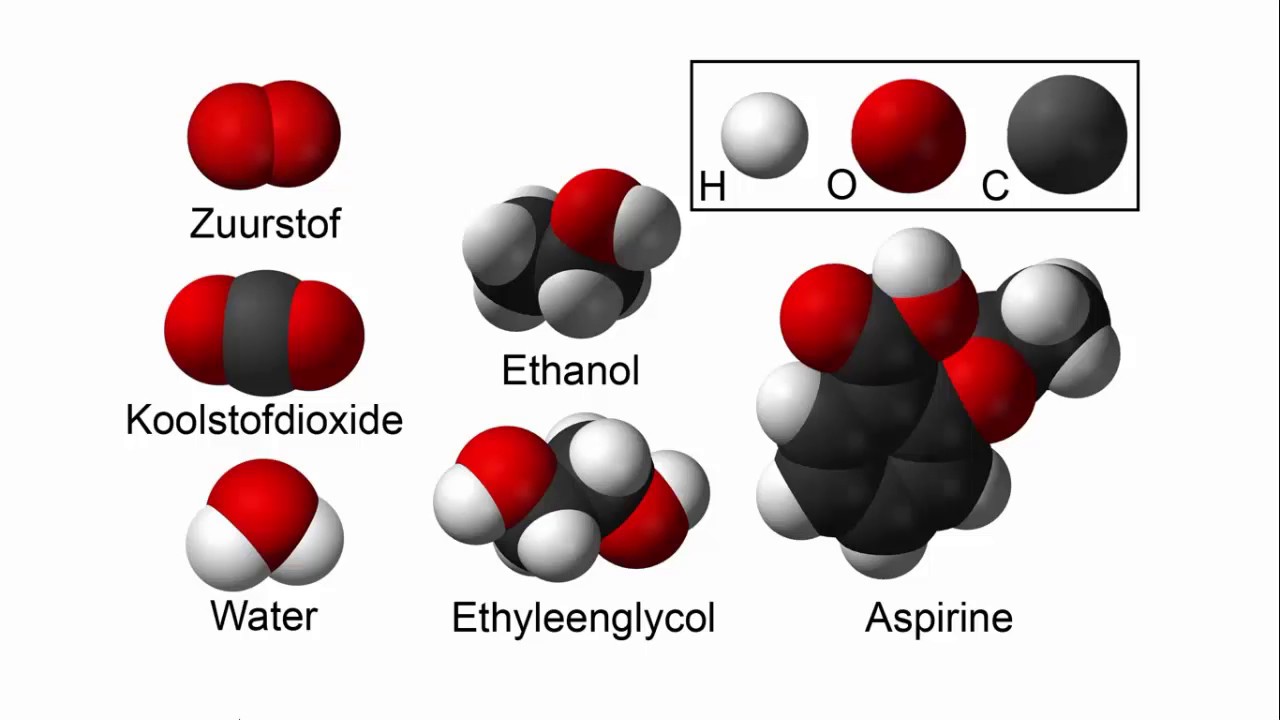
- Covalente Bindingen: Wanneer zuurstof reageert met andere niet-metalen, zoals waterstof (H) of koolstof (C), worden elektronen gedeeld tussen de atomen. Omdat zuurstof een hogere elektronegativiteit heeft, is de verdeling van de elektronen niet gelijkmatig en ontstaat er een polaire covalente binding. Water (H2O) is een uitstekend voorbeeld, waarbij de zuurstof een gedeeltelijke negatieve lading draagt en de waterstofatomen een gedeeltelijke positieve lading. Een ander voorbeeld is koolstofdioxide (CO2), waarbij zuurstof dubbele bindingen vormt met koolstof.
- Metaal-Zuurstof Bindingen: De binding tussen zuurstof en metalen in metaaloxiden kan een complex karakter hebben, met zowel ionische als covalente aspecten. De mate van ioniciteit of covalentie is afhankelijk van de elektronegativiteit van het metaal. Overgangsmetalen vormen vaak complexe oxiden met diverse structuren en eigenschappen.
Belangrijke Zuurstofverbindingen en Hun Rol
De verbindingen die zuurstof vormt zijn essentieel voor het leven en de industrie.
Water (H2O)
Water is wellicht de belangrijkste zuurstofverbinding. Het is essentieel voor alle bekende levensvormen en fungeert als oplosmiddel, transportmedium en reactant in talloze biologische en chemische processen. De polaire aard van watermoleculen is cruciaal voor zijn unieke eigenschappen, zoals het vermogen om waterstofbruggen te vormen, wat resulteert in een relatief hoog kookpunt en oppervlaktespanning.
Koolstofdioxide (CO2)
Koolstofdioxide is een belangrijk gas dat vrijkomt bij de ademhaling en verbranding. Planten gebruiken CO2 tijdens de fotosynthese om glucose te produceren en zuurstof vrij te geven. De toename van CO2-concentraties in de atmosfeer, voornamelijk door menselijke activiteiten zoals het verbranden van fossiele brandstoffen, draagt bij aan het broeikaseffect en de klimaatverandering. Metingen van CO2-concentraties in de atmosfeer, zoals die gedaan op Mauna Loa Observatory, tonen een gestage stijging sinds het begin van de industriële revolutie.
Oxiden van Metalen (Roest, Aluminiumoxide)
De reactie van metalen met zuurstof, vaak aangeduid als corrosie of roest, is een bekend fenomeen. IJzer reageert met zuurstof en water om roest te vormen (Fe2O3·nH2O), wat de structurele integriteit van ijzeren objecten aantast. Aluminium daarentegen vormt een dunne, beschermende laag aluminiumoxide (Al2O3) aan het oppervlak, waardoor verdere corrosie wordt voorkomen. Dit is de reden waarom aluminium veel wordt gebruikt in toepassingen waar corrosiebestendigheid belangrijk is.
Organische Zuurstofverbindingen (Alcoholen, Ethers, Esters)
Zuurstof vormt ook talloze organische verbindingen, die cruciaal zijn in de biochemie en organische chemie. Alcoholen (R-OH) bevatten een hydroxylgroep (-OH), ethers (R-O-R') bevatten een zuurstofatoom gebonden aan twee alkyl- of arylgroepen, en esters (R-COO-R') worden gevormd door de reactie van een alcohol en een carbonzuur. Deze verbindingen hebben uiteenlopende toepassingen, van oplosmiddelen en farmaceutische producten tot smaakstoffen en plastics.
Factoren die de Reactie van Zuurstof Beïnvloeden
Verschillende factoren kunnen de snelheid en de aard van de reactie tussen zuurstof en andere elementen beïnvloeden.
- Temperatuur: Hogere temperaturen verhogen over het algemeen de reactiesnelheid, omdat de atomen meer kinetische energie hebben en vaker en met meer kracht botsen.
- Concentratie: Hogere concentraties van reactanten (zuurstof en het andere element) leiden tot een hogere reactiesnelheid, omdat er meer kans is op botsingen.
- Katalysatoren: Katalysatoren zijn stoffen die de reactiesnelheid versnellen zonder zelf te worden verbruikt. Ze bieden een alternatieve reactieroute met een lagere activeringsenergie.
- Oppervlakte: Voor reacties waarbij een vaste stof betrokken is, is een groter oppervlak beschikbaar voor reactie van invloed op de snelheid. Fijne poeders reageren bijvoorbeeld sneller dan grote blokken.
- Aanwezigheid van water: Zoals gezien bij roest, kan de aanwezigheid van water de corrosiesnelheid aanzienlijk beïnvloeden.
Zuurstof in Biologische Systemen
Zuurstof is essentieel voor het leven zoals we dat kennen. De meest bekende rol is in de ademhaling, waarbij zuurstof wordt gebruikt om glucose af te breken en energie vrij te maken in de vorm van ATP (adenosinetrifosfaat). Dit proces staat bekend als cellulaire ademhaling en vindt plaats in de mitochondria van cellen. Zuurstof bindt aan hemoglobine in rode bloedcellen en wordt door het lichaam getransporteerd.
Naast de ademhaling speelt zuurstof een rol in tal van andere biologische processen, zoals de synthese van verschillende biomoleculen en de immuunrespons. Reactive oxygen species (ROS), zoals superoxide en waterstofperoxide, zijn bijproducten van het zuurstofmetabolisme en spelen een rol in signalering en immuunfunctie, maar kunnen ook celbeschadiging veroorzaken bij overmatige productie.
Conclusie
De verbinding van zuurstof met andere chemische elementen is een essentieel aspect van de chemie en heeft verregaande gevolgen voor ons begrip van de wereld. Van de vorming van water tot de corrosie van metalen en de ademhaling van levende organismen, zuurstof speelt een cruciale rol in een breed scala aan processen. Door de factoren te begrijpen die deze reacties beïnvloeden en de eigenschappen van de resulterende verbindingen, kunnen we nieuwe technologieën ontwikkelen, zoals duurzamere materialen en efficiëntere energiebronnen. Blijvend onderzoek en innovatie op dit gebied zijn essentieel om de uitdagingen van de klimaatverandering en de ontwikkeling van nieuwe technologieën aan te gaan. Verdere studie van zuurstofverbindingen kan leiden tot verbeterde brandstofcellen, betere corrosiebestendige materialen, en een dieper begrip van biologische processen.
Bekijk ook deze gerelateerde berichten:
- Kom Hier Dat Ik U Kus Boek
- Stoppen Met Roken Effecten Per Dag
- Serena Van Der Woodsen Echte Naam
- Wat Voor Een Werk Past Bij Mij
- Hoeveel Keer Heeft Duitsland Wk Gewonnen
- Levensverwachting Bij Ziekte Van Kahler
- Wat Voor Taal Spreken Ze In Marokko
- Wat Vieren We Met Kerst
- Wonen Er Mensen Op De Noordpool
- B.v. Koninklijke Van Kempen & Begeer
