Hoe Groot Is Een Atoom
Het atoom, de fundamentele bouwsteen van alle materie, is een onderwerp dat al eeuwenlang de nieuwsgierigheid van wetenschappers en filosofen prikkelt. Maar hoe groot is zo'n atoom eigenlijk? Het antwoord is verrassend klein, en om de schaal te begrijpen, moeten we ons verdiepen in de nanowereld, een rijk waar de wetten van de klassieke fysica soms vervagen en de kwantummechanica regeert.
De Schaal van het Atoom: Een Onvoorstelbare Kleinheid
Om een idee te krijgen van de grootte van een atoom, is het belangrijk om te beseffen dat het onmogelijk is om het met het blote oog te zien, of zelfs met een gewone microscoop. Atomen zijn veel kleiner dan de golflengte van zichtbaar licht, waardoor ze onzichtbaar zijn voor optische instrumenten. We spreken over nanometers (nm), waarbij 1 nm gelijk is aan 1 miljardste van een meter (10-9 meter).
Typische Atoomafmetingen
De grootte van een atoom wordt meestal uitgedrukt als zijn atoomradius, wat de afstand is van de atoomkern tot de buitenste elektronenwolk. De atoomradius varieert afhankelijk van het element. Waterstof, het kleinste atoom, heeft een radius van ongeveer 0,037 nm (37 picometer). Cesium, een van de grotere atomen, heeft een radius van ongeveer 0,265 nm (265 picometer). Dit lijkt misschien een klein verschil, maar op atomair niveau is het aanzienlijk.
Ter vergelijking:
- Een menselijke haar is ongeveer 80.000 tot 100.000 nanometer breed.
- Een rode bloedcel is ongeveer 7.000 nanometer in diameter.
De Atoomkern en Elektronenwolk
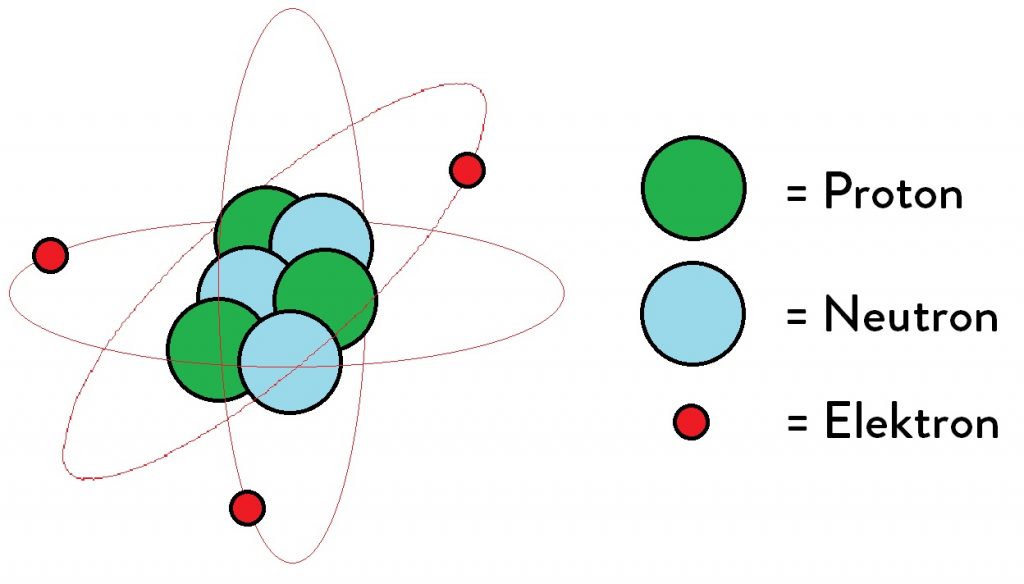
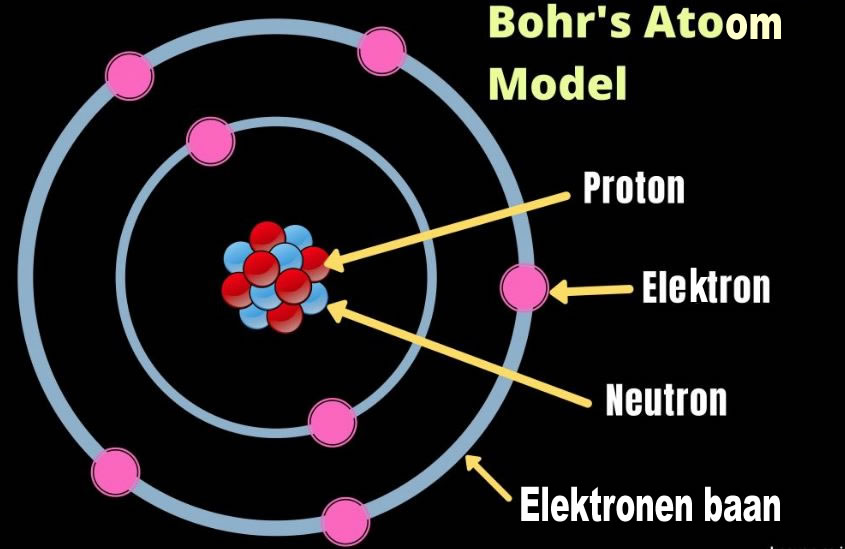
Het atoom bestaat uit een kleine, dichte kern, bestaande uit protonen (positief geladen) en neutronen (neutraal geladen), omringd door een veel grotere elektronenwolk. De kern is extreem klein in vergelijking met de totale grootte van het atoom. Als we de kern zouden vergelijken met een knikker in het midden van een voetbalstadion, dan zouden de elektronen zich ergens aan de rand van het stadion bevinden. De ruimte daartussen is grotendeels leegte.
Deze "leegte" is echter niet helemaal leeg. De elektronen bewegen zich in een complexe, driedimensionale ruimte rond de kern, beschreven door kwantummechanica. We kunnen hun exacte positie niet bepalen, maar we kunnen wel de waarschijnlijkheid berekenen van waar ze zich bevinden. Deze waarschijnlijkheidsverdeling vormt de elektronenwolk.
Methoden om Atoomafmetingen te Bepalen
Omdat we atomen niet direct kunnen zien, moeten we indirecte methoden gebruiken om hun grootte te bepalen. Enkele belangrijke technieken zijn:
Röntgenkristallografie
Deze techniek maakt gebruik van de diffractie van röntgenstralen door kristallen. Wanneer röntgenstralen op een kristal worden gericht, worden ze afgebogen door de atomen in het kristalrooster. Het diffractiepatroon dat ontstaat, kan worden gebruikt om de afstanden tussen de atomen te bepalen, en dus ook de atoomradius.
Scanning Tunneling Microscopy (STM) en Atomic Force Microscopy (AFM)
STM en AFM zijn krachtige microscopische technieken die het mogelijk maken om oppervlakken op atomair niveau af te beelden. STM maakt gebruik van een scherpe metalen punt die op zeer korte afstand van het oppervlak wordt gehouden. Door een kleine spanning aan te leggen, vloeit er een stroom (tunnelstroom) tussen de punt en het oppervlak. De hoeveelheid stroom is zeer gevoelig voor de afstand, waardoor het mogelijk is om atomen individueel te lokaliseren. AFM gebruikt een scherpe punt bevestigd aan een cantilever (een kleine balk). De punt scant het oppervlak en buigt door interacties met de atomen. De buiging van de cantilever wordt gemeten en gebruikt om een afbeelding van het oppervlak te construeren.
Theoretische Berekeningen
Naast experimentele methoden kunnen ook theoretische berekeningen worden gebruikt om atoomafmetingen te voorspellen. Deze berekeningen, gebaseerd op de principes van de kwantummechanica, kunnen zeer nauwkeurige schattingen geven van de atoomradius. Ze zijn vooral nuttig voor elementen die moeilijk te bestuderen zijn met experimentele methoden.
Waarom de Grootte van Atomen Belangrijk is
De grootte van atomen is van cruciaal belang voor het begrijpen van de eigenschappen van stoffen. Het beïnvloedt direct:
Chemische Reactiviteit
De grootte van een atoom speelt een belangrijke rol bij de chemische reactiviteit. Grotere atomen hebben over het algemeen een lagere ionisatie-energie (de energie die nodig is om een elektron te verwijderen) en zijn daardoor reactiever. De grootte van de atomen beïnvloedt ook hoe gemakkelijk ze bindingen kunnen vormen met andere atomen.
Dichtheid
De dichtheid van een stof wordt bepaald door de massa van de atomen en de manier waarop ze zijn gerangschikt. Kleinere atomen kunnen dichter op elkaar gepakt worden, wat resulteert in een hogere dichtheid. Bijvoorbeeld, iridium en osmium zijn twee van de dichtste elementen en hebben relatief kleine atoomradii.
Elektrische Geleiding
De grootte en rangschikking van atomen in een materiaal beïnvloeden de elektrische geleiding. In metalen zijn de buitenste elektronen (valentie-elektronen) relatief vrij om te bewegen door het rooster van atomen. De grootte van de atomen en de afstand ertussen beïnvloeden de bewegingsvrijheid van deze elektronen.
Materiaaleigenschappen
Van smeltpunt en kookpunt tot sterkte en flexibiliteit, de grootte van atomen draagt bij aan een scala aan materiaaleigenschappen. Het manipuleren van atomen op de nanoschaal, bijvoorbeeld bij de ontwikkeling van nanodeeltjes, maakt het mogelijk om materialen te creëren met nieuwe en verbeterde eigenschappen. Denk hierbij aan sterkere en lichtere composieten of effectievere medicijnen.
Real-World Voorbeelden en Data
Laten we enkele concrete voorbeelden bekijken:
- Lithium-ion batterijen: De kleine atoomradius van lithium maakt het mogelijk om meer lithiumionen in de batterij te stoppen, wat resulteert in een hogere energiedichtheid.
- Nanomaterialen: Goudnanodeeltjes worden gebruikt in medische beeldvorming en therapie vanwege hun unieke optische eigenschappen, die afhankelijk zijn van hun grootte.
- Halfgeleiders: De eigenschappen van halfgeleiders, zoals silicium, zijn extreem gevoelig voor de toevoeging van kleine hoeveelheden andere atomen (doping). De grootte en de elektronische structuur van deze atomen beïnvloeden de geleiding van de halfgeleider.
Hier is een tabel met de atoomradii van enkele veelvoorkomende elementen (in nanometers):
| Element | Atoomradius (nm) |
|---|---|
| Waterstof (H) | 0.037 |
| Koolstof (C) | 0.067 |
| Zuurstof (O) | 0.060 |
| Natrium (Na) | 0.190 |
| Silicium (Si) | 0.111 |
| Ijzer (Fe) | 0.156 |
| Goud (Au) | 0.135 |
Conclusie
De grootte van een atoom is ongelooflijk klein, maar heeft een enorme impact op de eigenschappen van materie. Het begrijpen van deze nanoschaal is cruciaal voor het ontwikkelen van nieuwe technologieën en materialen met verbeterde eigenschappen. Of het nu gaat om het ontwerpen van betere batterijen, het ontwikkelen van nieuwe medicijnen of het creëren van sterkere materialen, de kennis van atomaire afmetingen en hun invloed op de materie is onmisbaar.
Duik dieper in de wereld van de nanowetenschap en nanotechnologie! Verken de websites van universiteiten en onderzoeksinstituten die zich bezighouden met deze fascinerende gebieden. Je zult versteld staan van de mogelijkheden die zich openen wanneer we de materie op atomair niveau begrijpen en manipuleren. De toekomst van technologie en wetenschap ligt in de minuscule wereld van het atoom!